知识点一:极化作用
一、分解电压
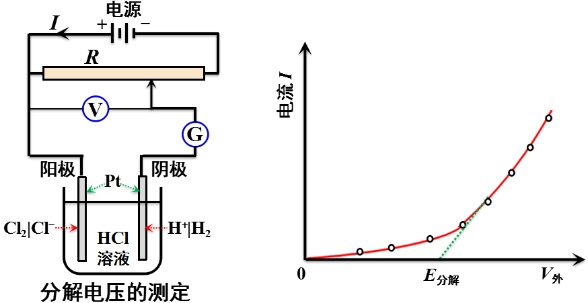
电解池中进行的反应:
阴极: ![]()
阳极: ![]()
总反应: ![]()
电解产物与溶液中相应的离子在阴、阳两极分别形成了氢电极和氯电极,从而构成了如下电池:
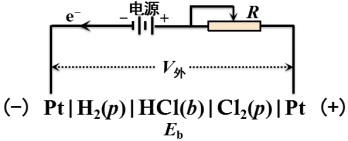
这是一自发电池,其电动势E与外加电压方向相反,故称为反电动势。因电解产物H2和Cl2向溶液扩散,使Eb减小,产生微小的电流(残余电流)。
外加电压的构成:![]()
![]() 残余电流
残余电流
当pH2和pCl2等于外压时,反电动势Eb达到最大值 ![]() ,此后电流几乎随外加电压直线上升:
,此后电流几乎随外加电压直线上升:
![]()
当外加电压等于分解电压![]() 时,电极所对应的电势称为析出电势。
时,电极所对应的电势称为析出电势。
二、极化与超电势
1. 电极的极化
当电流强度I趋于零时,电极处于电化学平衡状态,对应平衡电极电势![]() 。
。
当电流强度I大于零时,电极处于不可逆状态,对应电极电势为![]() 。
。
电极电势![]() 偏离
偏离![]() 的现象称为电极的极化。
的现象称为电极的极化。
定义超电势![]() :
:![]()
极化的原因:
1、浓差极化(扩散极化):
在有限电流通过电极时,因离子扩散的迟缓性而导致电极附近离子浓度与本体溶液浓度不同,从而使电极电势与![]() 发生偏离。
发生偏离。
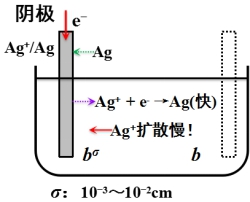
紧密层与溶液本体Ag+浓度不同:bσ< b
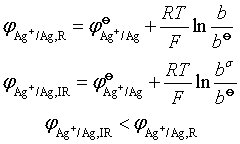
降低方法:搅拌等。
2、电化学极化(活化极化)
在有限电流通过电极时,由于电化学反应进行的迟缓性而导致电极上带电程度与可逆情况下不同,从而使电极电势偏离![]() 。
。
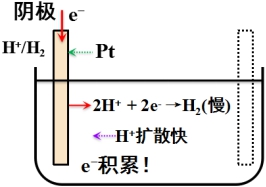
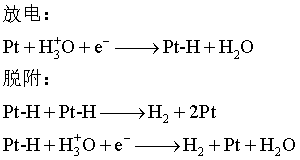
降低方法:镀铂黑等。
综上所述,阴极极化的结果,使电极电势变得更负;阳极极化的结果,使电极电势变得更正。
阴极:![]()
阳极:![]()
接下来让我们进行下一部分的学习
