演示实验:金属的腐蚀
一、实验目的
使学生了解金属腐蚀的基本原理和缓蚀剂的作用
二、演示方法
1.微电池
按下列成分配成铁锈指示剂:
![]()
![]()
![]()
![]()
![]() 酚酞
酚酞 ![]() ; 白明胶 适量。
; 白明胶 适量。
将铁锈指示剂加热成粘稠状,放置一会。待凝固之前,涂在去锈的铁片上。10分钟后 即可看到铁片上的阴阳极区。在阳极区,铁成二价铁离子进入溶液中,由于二价铁离子和铁氰化钾反应的结果而出现蓝色斑点。在阴极区,由于氧的去极化作用,指示剂变成弱碱性呈现出粉红色斑点,这个过程为:
在阳极:
![]()
![]()
在阴极:
![]()
OH-离子遇酚酞变成粉红色。
2.金属保护层
取一镀锡的铁片(可用废罐头盒子)用锉刀划破表面镀层,在划痕处滴几滴稀硫酸和一滴铁氰化钾,不久可以看见在划破处发生蓝色沉淀,说明铁层发生溶解。
另取镀锌铁一片同样进行操作,可以看到只有镀锌溶解而划痕处没有蓝色沉淀。
3.缓蚀剂
取一铁片放入20%的氯化氢溶液中,加热至60~70℃,则可以看到铁片迅速地溶解并产生氢气。如果此时加入六次甲基四胺(CH2)6N4(乌洛托平),则可以看到氢气泡消失,说明铁的腐蚀已经停止。
三、思考题:工业上防腐有哪些方法?
演示实验:电镀
一、实验目的
通过实验使学生了解几种因素对电镀的影响
二、演示方法
按图安置好电镀装置,进行以下实验。
1.电解质本性的影响
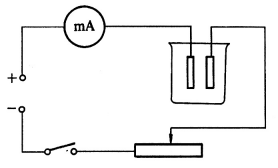
用简单盐或络盐作电镀液均可,但是简单盐的电镀效果总是比络盐差一些。例如用氰化物镀铜、锌、银比用这些金属的酸性电镀液有很多优点(如镀层致密,分散能力好等)。同时有些金属在简单盐的溶液中是很难镀上的。可以通过以下实验进行比较。
(a)在硝酸银溶液中镀银。在小烧杯中取![]() AgNO3溶液,插入两个银电极,通以直流电,则可看到在阴极上不断地产生树枝状的支晶,此时电沉积不能成层。
AgNO3溶液,插入两个银电极,通以直流电,则可看到在阴极上不断地产生树枝状的支晶,此时电沉积不能成层。
(b)在络盐中镀银。按下列配方配制电镀液:
AgCl ![]()
![]()
![]()
![]()
![]()
上述电镀液配好后发生如下的反应,生成银的络盐:
2AgCl+K4Fe(CN)6→K4Ag2(CN)6+FeCl2
将电镀液过滤除去浑浊物,即可进行电镀。电镀时的操作温度为15~18℃,电流密度为1.0~1.5![]() 。几分钟后,便可得到银白色的镀层。
。几分钟后,便可得到银白色的镀层。
2.pH的影响
用酸性镀液电镀时,pH的大小是很重要的。这一方面关系到阴极的电流效率,另一方面也影响镀层的质量。例如,在镀镍时酸性过强产生麻点;镀铜(或电解精铜)时酸性过强产生氢脆现象。
按下列配方配制电镀液:
![]()
![]() ;
;
![]()
![]() (增加电导的盐);
(增加电导的盐);
![]()
![]() (pH调节剂);
(pH调节剂);
NaCl ![]() (阳极腐蚀剂)。
(阳极腐蚀剂)。
在小烧杯中取上述电镀液35mL左右,用盐酸将电镀液的pH调至1。然后插入镍片作为阳极,铜片为阴极,通以直流电,调节电流密度为1~1.5![]() 。两分钟后可观察到阴极上析出大量的氢气,而镍的电沉积则很少。然后加入不含二氧化碳的氢氧化钠溶液使pH等于6,再进行电镀,这时镍的电沉积量有显著增加。最后调节pH大于7到溶液开始出现沉淀为止,再进行电镀,这时阴极上产生黑色的镀层。
。两分钟后可观察到阴极上析出大量的氢气,而镍的电沉积则很少。然后加入不含二氧化碳的氢氧化钠溶液使pH等于6,再进行电镀,这时镍的电沉积量有显著增加。最后调节pH大于7到溶液开始出现沉淀为止,再进行电镀,这时阴极上产生黑色的镀层。
3.添加剂的影响
添加剂分为有机添加剂与无机添加剂两种,添加剂可以使镀层致密、光亮,防止支晶与瘤的生成,提高电沉积的分散能力与极限电流密度。有些溶液不加添加剂则不能得到良好的镀层。
但是有些添加剂也往往会带来镀层脆弱等不良的影响。
按下列配方配制两种电镀液:
1号 |
2号 |
||
SnSO4 |
|
SnSO4 |
|
H2SO4 |
|
H2SO4 |
|
|
|
甲酚磺酸 |
|
在粗试管中注入1号电镀液约30mL,插入锡板为阳极,铜板为阴极进行电镀。电流密度保持在 ![]() ,这时在阴极上出现枝状电沉积。如果更换含有有机添加剂甲酚磺酸的2号电镀液,则可得到光亮的镀层。
,这时在阴极上出现枝状电沉积。如果更换含有有机添加剂甲酚磺酸的2号电镀液,则可得到光亮的镀层。

