第九章 不可逆电极过程
 知识点三:金属的电化学腐蚀及防腐
知识点三:金属的电化学腐蚀及防腐
金属腐蚀现象在人们的日常生活中是司空见惯的。比如,难于修理的汽车、自行车、洗衣机产生的红锈,海边钢结构建筑物的锈蚀,用铝锅装盐会穿孔,夏日旅行归来,自来水管里流出红水等。金属发生腐蚀后显著影响了它的使用性能,其危害还不仅仅是金属本身受损失,更严重的是金属结构遭破坏。有时,金属结构的价值比起金属本身来说要大得多,例如汽车、飞机及精密仪器等,制造费用远远超过金属的价格。据估计,全世界每年因腐蚀而不能使用的金属制品的重量约相当于金属年产量的1/4到1/3。而在这些损失中,如能充分利用腐蚀与防腐知识加以保护的话,有近1/4是完全可以避免的。
金属的腐蚀与防腐往往是涉及广泛领域的复杂问题,那么为什么在电化学里要讨论金属腐蚀问题呢?主要是因为大部分的金属腐蚀现象是由于电化学的原因引起的。
一、金属的电化学腐蚀
金属表面由于外界介质的化学或电化学作用而造成的变质及损坏的现象或过程称为腐蚀。当金属表面与介质如气体或非电解质液体等因发生化学作用而引起的腐蚀称作化学腐蚀。发生化学腐蚀时没有电流产生。当金属表面在介质如潮湿空气、电解质溶液等中,因形成微电池而发生电化学作用而引起的腐蚀,叫做电化学腐蚀。在腐蚀作用中最为严重的是电化学腐蚀。
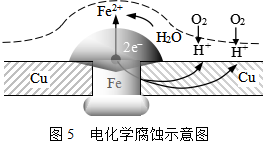
引起电化学腐蚀的原因是由于金属器件的各组成部分之间形成原电池,产生了电化学反应,使金属氧化。例如,一个铜制器件,上面打了铁的铆钉(如图5所示),长期暴露在潮湿空气中,在铆钉的部位特别易生锈,这是因为在器件表面会凝结一层薄薄的水膜,空气中的CO2,工厂区的SO2,沿海地区潮湿空气中的NaCl都能溶解到水膜中形成薄层电解质溶液,形成了原电池。铁是负极,铜是正极。负极一般都是金属的溶解过程(即金属被腐蚀的过程),这里Fe发生氧化:
Fe (s) → Fe2+ (![]() Fe2+) + 2e-
Fe2+) + 2e-
大气里的氧扩散到薄层电解质在铜极上接受电子还原
O2 (g) + 4H+ (![]() H+) + 4e- → 2H2O (l)
H+) + 4e- → 2H2O (l)
由于两种金属紧密连接,电池反应不断地进行,Fe变成Fe2+进入溶液,多余的电子移向铜极,在铜极上氧气和氢离子被消耗掉,生成水,Fe2+则与溶液中的![]() 结合,生成
结合,生成![]() ,然后又和潮湿空气中水分和氧作用,生成铁锈(铁的各种氧化物和氢氧化物的混合物)。其化学反应以下式表示:
,然后又和潮湿空气中水分和氧作用,生成铁锈(铁的各种氧化物和氢氧化物的混合物)。其化学反应以下式表示:
4Fe(OH)2(s)+2H2O(l)+O2(g) ![]() 4Fe(OH)3(s)
4Fe(OH)3(s)
导致铁的电化学腐蚀。
以上是由于器件中有二种不同金属而引起的腐蚀。即便是同一种金属如铁器或钢板,当它们与电解质溶液接触时,由于金属表面可能含一些杂质,由于金属的电势和杂质的电势不尽相同,这就构成了以金属和杂质为电极的许多微小的短路电池,称为微电池(或局部电池),因而引起腐蚀。
腐蚀电池电动势的大小影响腐蚀的倾向和速度。两种金属一旦构成微电池后,有电流通过电极,电极就要发生极化,而极化作用则会改变腐蚀电池的电动势。因而需要研究极化对腐蚀的影响。一般用电化学方法研究金属腐蚀可以迅速地得到金属在溶液中的腐蚀速度数据以及找出各种因素对腐蚀的影响;其次用电化学方法探讨腐蚀的机理比其它方法容易,弄清了腐蚀反应机理后,就采取措施尽可能把腐蚀速度降至可忽略或可接受的程度。
当金属浸入溶液中按电化学机理被腐蚀时,有时在金属和溶液的界面上,即使没有净电流流过,仍有净的化学反应在进行着,这时所建立起来的电极电势称为腐蚀电势。在腐蚀着的金属与溶液界面上同时进行着两对,或者更多的、不同的氧化还原反应。例如,某金属浸在酸溶液中有
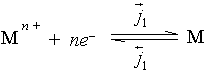 和
和 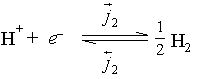
这样两对氧化还原反应同时进行着。没有净电流通过,就意味着电荷在两相的转移是平衡的,即有
![]()
但是往往
![]() ,
,![]()
也就是说,物质的转移是不平衡的,金属溶解和氢气产生的净速度分别为![]() 和
和![]() 。一般情况下,金属离子的放电速度和氢气分子的电离速度都很小,可略去不计,即
。一般情况下,金属离子的放电速度和氢气分子的电离速度都很小,可略去不计,即
![]() 和
和 ![]()
则有
![]()
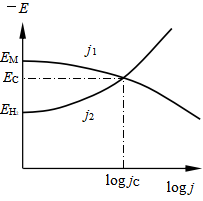
将有金属不断溶解,氢不断析出。这就产生金属不断被腐蚀的情况。在酸溶液中金属溶解![]() 和氢析出
和氢析出![]() 的总速度与电极电势关系如图6所示。图中
的总速度与电极电势关系如图6所示。图中![]() 是金属在酸溶液中的可逆电势,
是金属在酸溶液中的可逆电势,![]() 是氢的可逆电势,
是氢的可逆电势,![]() 是腐蚀电势(也称稳定电势或混合电势),在此电势时
是腐蚀电势(也称稳定电势或混合电势),在此电势时![]() ,
,![]() ,
,![]() 即是金属在酸溶液中的自发溶解速度或称腐蚀速度。影响金属表面腐蚀速度的因素主要有金属极化性能、金属的可逆电极电势和氢在金属表面上的超电势。
即是金属在酸溶液中的自发溶解速度或称腐蚀速度。影响金属表面腐蚀速度的因素主要有金属极化性能、金属的可逆电极电势和氢在金属表面上的超电势。

二、金属的电化学防腐蚀
从腐蚀角度保护金属材料最简单易行的方法是将材料与腐蚀环境隔离。例如有机涂料、无机物的搪瓷等涂覆金属表面以使材料与腐蚀环境隔绝。当这些保护层完整时是能起到保护作用的。这里主要介绍已广为人们所采用的电化学防腐蚀方法。
1.金属镀层。用电镀法在金属的表面涂一层别的金属或合金作为保护层。例如自行车上镀铜锡合金垫底,然后镀铬,铁制自来水管镀锌以及某些机电产品镀银或金等都可以达到防腐蚀目的。电镀是借助于电解作用,在金属制件表面上沉积一薄层其他金属的方法。包括镀前处理(除油、去锈)、镀上金属层和镀后处理(钝化、去氢)等过程。电镀时,将金属制件作为阴极,所镀金属作为阳极,浸入含有镀层成分的电解液中,并通入直流电,经过一段时间即得沉积镀层。
2.阳极保护。它是指用阳极极化的方法使金属钝化,并用微弱电流维持钝化状态,从而保护金属。此法是基于对金属钝化现象的研究提出的。因此,要弄清阳极保护的原理,首先要明白金属钝化的原理。
金属阳极溶解时,在一般情况下,电极电势愈正,阳极溶解速度愈大。但在有些情况下,当正向极化超过一定数值后,由于表面某种吸附层或新的成相层的形成,金属的溶解速度非但不增加,反而急剧下降。
在金属被化学溶解时也有类似情形。例如铁浸在硝酸溶液中,随着硝酸浓度的升高,铁的溶解速度加快。但当硝酸浓度超过某一临界值后,铁的溶解速度反而显著降低。这种在强化条件下金属正常溶解反而受到阻抑的现象叫做金属的钝化。
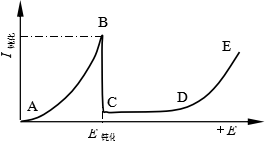
用控制电势法测定阳极极化曲线,可以清楚地了解金属的钝化过程。如图7所示就是典型的恒电势阳极极化曲线。曲线分为四个区域:AB段为活性溶解区,金属进行正常的阳极溶解。当电势达到![]() 时,金属发生了钝化过程。金属的溶解速度剧烈降低,故
时,金属发生了钝化过程。金属的溶解速度剧烈降低,故![]() 为临界钝化电势。BC段是过渡钝化区,金属表面由活化状态过渡到钝化状态。CD段是稳定钝化区,这一段电势区通常达1-2V,有的金属甚至可达几十伏,在此电势范围内金属的钝化达到稳定状态,金属的溶解速度达到最低值,在整个CD段溶解速度几乎保持不变。DE段是过钝化区,当
为临界钝化电势。BC段是过渡钝化区,金属表面由活化状态过渡到钝化状态。CD段是稳定钝化区,这一段电势区通常达1-2V,有的金属甚至可达几十伏,在此电势范围内金属的钝化达到稳定状态,金属的溶解速度达到最低值,在整个CD段溶解速度几乎保持不变。DE段是过钝化区,当![]() 进入DE段,这时金属溶解速度又重新加快,造成这一现象有两种可能的原因,一是金属的高价态溶解,另一种可能是发生了其他的阳极反应,例如氧的析出。
进入DE段,这时金属溶解速度又重新加快,造成这一现象有两种可能的原因,一是金属的高价态溶解,另一种可能是发生了其他的阳极反应,例如氧的析出。
![]()
根据以上分析可知,如果把浸在介质中的金属构件和另一辅助电极组成电池,用恒电势仪把金属构件的电势控制在CD段内,则可以把金属在介质中的腐蚀降低到最小限度。这种用阳极极化使金属得到保护的方法叫阳极保护。具体实施时,可把准备保护的金属器件作阳极,以石墨为阴极,通入大小一定的电流密度。并使阳极电位维持在钝化区间,这样金属器件就得到了保护。在钝化态,金属的溶解速度一般是![]() ,比活化态小一千倍到一百万倍,因而可以认为金属是得到了保护。
,比活化态小一千倍到一百万倍,因而可以认为金属是得到了保护。
我国许多化肥厂对碳酸铵生产中的碳化塔实施阳极保护收到了显著效果。塔内阴极布置和电路如图8所示,即把整个塔体、塔内的冷却水箱、角钢、槽钢等为阳极,接到整流器的正极上;在塔内合理地布置一定数量的碳钢阴极,接到整流器的负极。阳极与阴极的面积之比约为13:1。当碳化氨水缓缓输入塔内时,通以大电流。随溶液的上升,碳钢逐步地建立钝化。当碳钢进入钝化区后,降低电流维持在钝化区间,并将阳极电势控制在+700mV左右,不超过+900mV。
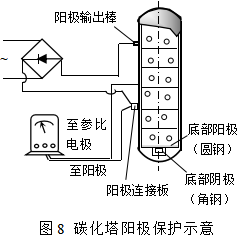
化学工业主要利用金属或各种合金制作反应器和储罐,因此,阳极保护法在化工生产中的应用十分广泛。
3.阴极保护。它是使金属体阴极极化以保护其在电解质中免遭腐蚀的方法。若阴极电势足够负,金属就可以不氧化(溶解),即达到完全的保护。阴极极化可用两种办法实现:(1)外加电流法:在电解质中加入辅助电极,连接外电源正极,而将需要保护的金属基体连接外电源负极,然后调节所施加的电流,使金属体达到保护所需的阴极电势。更多的是用大功率恒电势仪控制被保护金属的电势。(2)牺牲阳极法:在金属基体上附加更活泼的金属,在电解质中构成短路的原电池,金属基体成为阴极,而活泼金属则成为阳极,并不断被氧化或溶解掉。例如船体钢板在含2~3%NaCl的海水中很容易腐蚀,为了防止船身的腐蚀,除了涂油漆外,还在船体的底下每隔10米左右焊一块锌的合金作为防腐蚀措施。船身淹在海水里,形成了以锌为负极、铁为正极,海水为电解质的局部电池,此电池受腐蚀时溶解的是锌而不是铁。在这样的腐蚀过程中,锌是作为阳极牺牲了,但却保护了船体。
4.缓蚀剂保护。加入到一定介质中能明显抑制金属腐蚀的少量物质称为缓蚀剂。例如在酸中加入千分之几的磺化蓖麻油、乌洛托品、硫脲等可阻滞钢铁的腐蚀和渗氢。由于缓蚀剂的用量少,既方便又经济,故是一种最常用的方法。缓蚀剂的防蚀机理可分为促进钝化、形成沉淀膜、形成吸附膜等。钝化促进型的缓蚀剂有铬酸盐、亚硝酸盐,由于它们有强的氧化能力,促进钢铁材料钝化。为了维持钝化,使用时浓度达1×10-4%~2×10-4%,而且铬酸盐污染环境,近年来几乎已停止使用。形成沉淀膜的典型缓蚀剂有聚磷酸盐、聚硅酸盐、有机磷酸盐等,它们与腐蚀生成物或环境中存在的Ca2+、Mg2+等离子形成沉淀膜从而抑制腐蚀。形成吸附膜的缓蚀剂多数是有机物,物理吸附或化学吸附在金属表面形成单分子层或多分子层吸附膜,将金属表面与腐蚀环境隔开。这类缓蚀剂分子是由含有能吸附于金属表面、电负性大的N、O、P、S的极性基和阻碍腐蚀性介质与金属接触的非极性基(烃基)所组成。并且,缓蚀剂的分子结构不同,其防蚀效果差别很大。例如![]() 和
和![]() 具有如下结构:
具有如下结构:
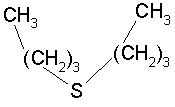
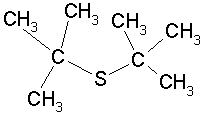
前者对硫的吸附没有立体障碍,可以取得相当理想的防蚀效果,后者,其烷基成了吸附的障碍,防蚀效果不好。而且,即使是吸附膜缓蚀剂,一般是刚开始使用时,依靠吸附膜的作用保护金属,但经过一段时间后它与溶解的金属离子反应生成不溶性螯合物,并形成沉淀膜,起到抑制腐蚀的作用。评价缓蚀剂或是阴极保护的防蚀效果时,用防蚀率(保护率)P表示:
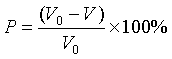 (16)
(16)
式中![]() 是没有保护时的腐蚀速度(电流),
是没有保护时的腐蚀速度(电流),![]() 是保护以后的腐蚀速度。
是保护以后的腐蚀速度。![]() 表示达到完全防蚀。
表示达到完全防蚀。![]() 表示加速了腐蚀。
表示加速了腐蚀。
总之,防止金属腐蚀根据具体情况可以采用多种方法,但是,最根本的还是要多研制新的各种各样的耐腐蚀材料如特种合金、陶瓷材料等以满足各种需要。
