第十章 表面物理化学
 知识点二:弯曲表面的附加压力和蒸气压
知识点二:弯曲表面的附加压力和蒸气压
一、弯曲表面下的压力
由于表面张力的作用,在弯曲表面下的液体或气体的受力情况与表面为平面时不同,前者受到一附加压力ps。
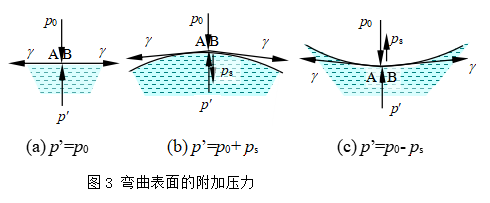
设在液面上有一小块面积AB(图3),沿AB的周界,AB以外的表面对AB面有表面张力的作用,力的方向与AB的周界垂直,与表面相切,使表面收缩。如果表面是水平的,则表面张力γ也是水平的(如图a),当平衡时,沿周界的表面张力互相抵消,合力为零,此时液面下的液体所受到的压力与液面上相等,即p′=p0。如果液面是弯曲的,则沿AB周界上的表面张力γ不是水平的,其方向如图b、c所示。平衡时,表面张力将产生一合力ps,而使弯曲液面下的液体所受实际压力与p0不同。当液面为凸形时,合力指向液体内部,液面下的液体所受实际压力p′=p0+ps;当液面为凹形时,合力指向液体外部,液体的实际压力p′=p0-ps。这一合力ps,即为弯曲表面受到的附加压力,附加压力的方向总是指向曲率中心。
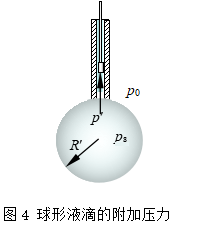
附加压力的大小与表面的曲率半径有关。设有一毛细管内充有液体,管端有半径为R′的球形液滴与管内液体处于平衡状态(图4)。液滴表面为凸形,因而受到指向液体内部的附加压力ps。若液滴外的压力为p0,则液滴所受压力 p´=p0+ps。因处于平衡,故管内液面上所受的压力也应为p′=p0+ps。若管内活塞位置向下移动使管内液体体积减少dV,则液滴的体积将增加dV,液滴表面积相应增加dA。此时环境对系统作功p´dV,液体对环境作功p0dV,环境对液体做净功(p′-p0)dV,此功用于克服表面张力而增加液滴的表面积dAs,即表面功γdAs,故有
![]()
因为球面积![]() ,球体积
,球体积 ,所以
,所以
![]()
![]()
将其代入前式得
![]()
即 ![]()
又(p′-p0)=ps,故
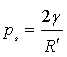 (10a)
(10a)
对于凹面液体,(p′-p0)=﹣ps,则
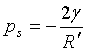 (10b)
(10b)
通常只注意附加压力的大小和方向,而不强调其正负,但应明确,附加压力总是指向曲率中心。
由以上两式可知:在一定温度下,(1)对指定液体而言,附加压力与表面曲率半径成反比,曲率半径越小(或曲率越大),附加压力的数值越大。(2)对于平液面,R′=∞,ps=0,液体所受实际压力与外压相等;对于凸液面,ps>0,液体所受实际压力p´=p0 +ps,实际压力与外压之差∆p=p´-p0 =ps>0;对于凹液面,液体所受实际压力p´=p0 -ps,实际压力与外压之差∆p=p´-p0 =-ps>0。有些教材将∆p定义为附加压力,请读者注意两个定义的区别。(3)对不同液体而言,液面的曲率相同时,附加压力与表面张力成正比。(4)对于球形液膜,例如肥皂泡的膜,有内、外两个球形表面,外表面是凸液面,内表面是凹液面,产生的附加压力均指向泡内,所以肥皂泡内气体的压力大于泡外气体的压力,其压力差![]() 。
。

在不受外加力场影响时,自由液滴或气泡通常呈球形,一方面是因为一定体积情况下,球形表面积最小, 另一方面也是附加压力作用的结果。因为若液滴呈不规则形状(如图5),则凸面处受到指向液滴内的附加压力,而凹面处则受到相反方向的附加压力,并且附加压力的大小与各处的曲率半径有关。在这些不平衡力的作用下,必然迫使液滴呈现球形,液滴才处于稳定状态。
例2 已知293.2K时水的表面张力 =0.0728N﹒m-1,试计算在该温度下半径r=10-8m的小水滴所需承受的附加压力。
=0.0728N﹒m-1,试计算在该温度下半径r=10-8m的小水滴所需承受的附加压力。
解 对于球形液滴,曲率半径与液滴半径相等,即R’=r,所以
![]()
可见小水滴的附加压力是相当大的。
二、毛细管现象
把毛细管插入液体中,管中液面则呈凹形或凸形曲面,这取决于液体与管壁的接触角。若管中液面呈凹形,则曲面受一向上的附加压力,曲面下的液体受到的压力p′<p0(图6),则管外液体被压入管中而使管内液面上升;若管中液面呈凸形,则情况相反。这种液体在毛细管内上升或下降的现象称作毛细管现象。
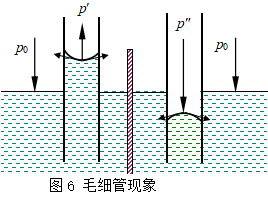
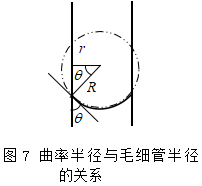
利用毛细管现象,可以测定液体的表面张力。以毛细管中液体上升为例(图7), 设毛细管半径为r,管内液面可近似地看作是球形的一部分,并设该面的曲率半径为R′,则附加压力![]() ,方向向上,因而曲面下的液体受到的实际压力小于平面液体的压力,至使管内液柱上升一定高度,直到产生的静压力与向上的附加压力抵消为止,即
,方向向上,因而曲面下的液体受到的实际压力小于平面液体的压力,至使管内液柱上升一定高度,直到产生的静压力与向上的附加压力抵消为止,即
![]() (11)
(11)
Δρ为液体与气体的密度差。则液体在毛细管中上升的高度为
![]() (12)
(12)
由几何关系(见图7)可得R′与r的关系为r=R′cosθ,θ为液体与毛细管壁的接触角。代入上式得
![]() (13)
(13)
可见,毛细管半径r越小,液面上升得越高.如果管内液面呈凸形,则θ>90o,cosθ<0,h<0,即管内液面下降。毛细管法测定液体的表面张力就是根据这个道理。
三、弯曲表面上的蒸气压
平面液体在一定的温度下具有一定的饱和蒸气压,若将液体分散成半径为R′的小液滴,则由于附加压力的影响,液滴所受压力比平面时大,因而液滴的饱和蒸气压也会增大。
如图11.8,设在某温度T时,平面液体所受压力为p0,其蒸气压为pv;球形液滴所受压力为p′=p0+ps,蒸气压为pv′。

根据第二章中讨论的外压对蒸气压的影响(第四章),可以得到
![]()
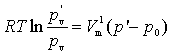
由于![]()
![]() ,
, ![]() (M为液体的摩尔质量,ρ为液体密度),代入上式得
(M为液体的摩尔质量,ρ为液体密度),代入上式得
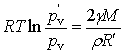 (14a)
(14a)
若液面为凹形,则为
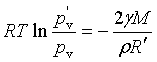 (14b)
(14b)
式(14)称为开尔文(Kelven)公式。由于温度一定时,![]() 、M、ρ、R、T均为常数,故液滴半径
、M、ρ、R、T均为常数,故液滴半径![]() 越小,其饱和蒸气压越大。表3列出的是按式(14)计算的不同半径的水滴的饱和蒸气压。对于凹形液面, pv′<pv,即凹面液体的蒸气压小于正常的饱和蒸气压,曲率半径越小,凹面液体的蒸气压越小。表4列出了不同半径的凹面液体的饱和蒸气压。
越小,其饱和蒸气压越大。表3列出的是按式(14)计算的不同半径的水滴的饱和蒸气压。对于凹形液面, pv′<pv,即凹面液体的蒸气压小于正常的饱和蒸气压,曲率半径越小,凹面液体的蒸气压越小。表4列出了不同半径的凹面液体的饱和蒸气压。
表3 水滴的半径与其饱和蒸气压(293.2K,pv=2337Pa)
r/cm |
10-4 |
10-5 |
10-6 |
10-7 |
pv′/pv |
1.001 |
1.011 |
1.114 |
2.95 |
表4 凹形水面上的饱和蒸气压(293.2K,pv=2337Pa)
r/cm |
10-4 |
10-5 |
10-6 |
10-7 |
pv′/pv |
0.9969 |
0.9891 |
0.8977 |
0.3390 |
例3 293.2K时,水的饱和蒸气压为2.337kPa,水的密度![]() ,表面张力
,表面张力![]() 。试求293.2K,半径r=10-9m的小水滴的饱和蒸气压。
。试求293.2K,半径r=10-9m的小水滴的饱和蒸气压。
解 由开尔文公式可得
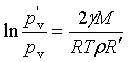
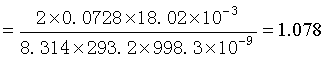
![]()
则 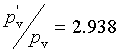
![]()
由于凹面液体的饱和蒸气压比平面液体的小,若液体在毛细管内呈凹液面,则一定温度下对平面液体尚未达到饱和的蒸气对凹面液体却可能达到饱和而在毛细管中凝结为液体,这种现象为毛细管凝聚。
对于通常的液体或固体,表面层分子占的比例较小,表面现象并不显著,可以忽略不计。但是,当系统中有新相产生的时候,例如蒸气的凝结、液体的沸腾、液体的结晶等,由于经历从无到有,从小到大的过程,最初产生的液滴、气泡或颗粒极其微小,因而具有很大的表面吉布斯自由能而使系统处于不稳定的状态(称作亚稳态),引起各种过饱和现象发生。
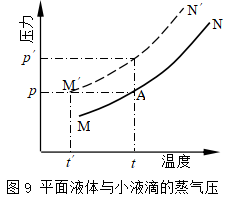
过饱和蒸气:当气体凝结成液体时,首先要有小液滴产生,而小液滴的蒸气压大于平面液体的蒸气压,如图9所示,曲线MN和M′N′分别表示平面液体和微小液滴的饱和蒸气压曲线。若在t时,压力为p的蒸气对平面液体已达饱和状态(A点),但对小液滴却未达饱和。若维持温度不变,需将蒸气压力升高至p′,或维持压力不变将温度降至t′,才能达到小液滴的饱和状态而有液滴产生。若蒸气的过饱和程度不够,则小液滴既不能产生,也不可能存在。这种按照相平衡的条件,应当凝结而未凝结的蒸气,称为过饱和蒸气。
高空中如果没有灰尘,水蒸气可以达到相当高的过饱和程度而不致凝结成水滴。如果用飞机向空中喷撒干冰或AgI小颗粒,则这些固体颗粒就成为水的凝结中心,使开始形成的水滴的曲率半径加大,从而在较低的水蒸气过饱程度时使水蒸气迅速凝结成水滴,这就是人工降雨的原理。
过热液体:液体在沸腾时,不仅在液体表面上进行气化,而且在液体内部要自动地生
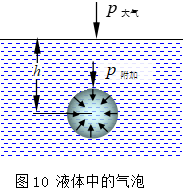
成微小气泡(图10),然后小气泡逐渐长大并上升至液面。在沸点时,平面液体的饱和蒸气压等于外压(一般为101 kPa),而最初形成的半径极小的气泡内的饱和蒸气压虽然也接近于外压,但小气泡一经形成,所需承受的压力除外压(p0)外,还有液体的静压力(ρgh)和附加压力ps,气泡越小,ps越大,所以气泡内的压力远远小于需要承受的压力,小气泡不可能存在。这种按照相平衡的条件,达到正常沸点而不沸腾的液体,称为过热液体。若要使小气泡存在,必须继续加热,使小气泡内蒸气的压力等于或超过它需要承受的压力,小气泡才可能产生,此时液体的温度必然高于正常沸点。当大量小气泡突然生成时,液体爆沸。
为了防止液体过热,常在液体中投入素烧瓷片或毛细管等多孔性物质,其中贮存有气体,加热时这些气体成为新相的种子,因而绕过了产生微小气泡的困难阶段,使液体的过热程度大大降低,不致发生爆沸。
过饱和溶液:开尔文公式对于溶质的溶解度也可适用,只要将式中的蒸气压换成溶质的饱和浓度即可,即微小晶体颗粒的饱和浓度大于普通晶体的饱和浓度。温度一定时,晶体颗粒越小,则1/R′越大,溶解度也越大。所以当溶液在定温下浓缩时,溶质的浓度逐渐增大,达到普通晶体的饱和浓度时,对微小晶体却仍未达到饱和状态,因而不可能析出微小晶体。若要自动生成微小晶体,还需进一步蒸发溶液,达到一定的过饱和程度时,小晶体才可能不断析出。这种按照相平衡的条件,应当析出而未析出晶体的溶液,称为过饱和溶液。
在结晶过程中,如果溶液的过饱和程度太大,会生成大量过于细小的晶体颗粒,给过滤和洗涤带来困难,并影响产品质量。在实际操作中,常常向饱和溶液中投入小晶体作为新相的种子,防止溶液的过饱和程度过高,并获得较大颗粒的晶体。
