第十章 表面物理化学
 知识点三:溶液的表面性质
知识点三:溶液的表面性质
一、溶液的表面张力
溶液的表面张力与纯溶剂的表面张力是不同的。例如,当无机盐类或不挥发的酸、碱等溶入水中后,由于这些物质的离子对水分子的吸引,使表面层分子受到的指向液体内部的拉力增大,因而扩大表面积时所消耗的表面功增加,使溶液的表面张力大于纯水的表面张力。相反,当水中溶入有机物后,会使溶液的表面张力小于纯水的表面张力。溶液中溶质的浓度不同,溶液的表面张力增大或降低的多少也不同。一般说来,溶液浓度(c)对表面张力(γ)的影响有三种情况,如图11所示。 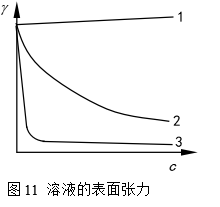
1.表面张力随溶液浓度增加而增大,且近于直线上升。如无机盐、H2SO4、KOH、蔗糖、甘露醇等水溶液。
2.表面张力随溶液浓度增加而降低。中等碳链以下的醇、醛、酸、酯等绝大部分有机化合物的水溶液。
3.溶液浓度低时,表面张力随溶液浓度增加急剧下降,当溶液浓度达到一定值后,表面张力不再随浓度变化。当溶液有杂质时,曲线上有时会出现最低点。属于这种情况的有长链的脂肪酸盐、8个碳以上的直链有机酸盐、烷基硫酸酯盐、烷基苯磺酸盐等,即肥皂和多种洗涤剂。
物质能降低水的表面张力的性质称作表面活性,所以上述第2、3类物质均具有表面活性,属表面活性物质。但通常只将能显著降低水的表面张力的物质叫做表面活性剂,即只有第3类物质是表面活性剂。
表面活性剂在结构上的特点是一个分子包含有亲水的极性基(如:OH、-COOH、-COO、-SO3等)和憎水的非级性基(如碳氢链等)两部分,所以又称作两亲分子。亲水的极性基力图进入溶液内部而憎水的非极性基倾向于逃离水溶液而伸向空气,因此表面活性剂的分子易于在溶液表面上聚集。
关于浓度对表面张力的影响,目前还没有完整的理论公式, 希什科夫斯基经验式将大多数有机物的稀水溶液![]() 与с的关系表示为
与с的关系表示为
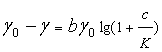 (16)
(16)
式中![]() 和
和![]() 分别为纯溶剂和溶液的表面张力;b为常数,同系的b值相同,脂肪酸类的b值约为0.411;K是与物质本性有关的常数,含碳数增加时,K值降低:
分别为纯溶剂和溶液的表面张力;b为常数,同系的b值相同,脂肪酸类的b值约为0.411;K是与物质本性有关的常数,含碳数增加时,K值降低:
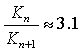 (17)
(17)
由式(16)可知,当c=K时,对于脂肪酸类表面活性剂,![]() ,所以K是使纯水的表面张力降低12%的溶液的浓度。
,所以K是使纯水的表面张力降低12%的溶液的浓度。
式(16)也可表示为
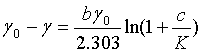 (18)
(18)
当浓度很低时,展开上式中的对数级数,略去含c的高次项得
![]()
此时表面张力的降低与溶液浓度成正比。
二、溶液的表面吸附
在定温定压下,液体总是自动地降低表面吉布斯吉布斯自由能以达到稳定状态,而吉布斯自由能的降低通常有两条途径,一是缩小表面积,二是降低表面张力。对于纯液体,定温定压下![]() 为定值,因而只能尽量地缩小表面积而降低表面吉布斯自由能,但是对于溶液,由于表面张力与溶液的浓度有关,所以还可通过调节溶液的浓度来降低表面张力,从而降低表面吉布斯自由能。当所加入的溶质能降低表面张力时,则溶质力图聚集在表面以使表面张力降低得最多,此时表面层浓度大于体相内部的浓度;相反,当所加入的溶质使表面张力增大时,则溶质力图进入溶液内部,而使表面层的浓度小于体相内部浓度。当然,表面层与相本体的浓度差又必然引起溶质分子的扩散而使浓度均一。当这两种相反的趋势达到平衡时,溶液表面层的组成与本体溶液的组成不相同,这种现象称为溶液的表面吸附作用。若溶质在表面层的浓度大于它在本体溶液中的浓度则为正吸附,反之,则为负吸附。显然,溶质为表面活性物质时,发生正吸附,而溶质为非表面活性物质时,发生负吸附。
为定值,因而只能尽量地缩小表面积而降低表面吉布斯自由能,但是对于溶液,由于表面张力与溶液的浓度有关,所以还可通过调节溶液的浓度来降低表面张力,从而降低表面吉布斯自由能。当所加入的溶质能降低表面张力时,则溶质力图聚集在表面以使表面张力降低得最多,此时表面层浓度大于体相内部的浓度;相反,当所加入的溶质使表面张力增大时,则溶质力图进入溶液内部,而使表面层的浓度小于体相内部浓度。当然,表面层与相本体的浓度差又必然引起溶质分子的扩散而使浓度均一。当这两种相反的趋势达到平衡时,溶液表面层的组成与本体溶液的组成不相同,这种现象称为溶液的表面吸附作用。若溶质在表面层的浓度大于它在本体溶液中的浓度则为正吸附,反之,则为负吸附。显然,溶质为表面活性物质时,发生正吸附,而溶质为非表面活性物质时,发生负吸附。
三、吉布斯吸附公式
吉布斯用热力学方法推导出一定温度下,溶液的浓度、表面张力和表面吸附量之间的定量关系,即著名的吉布斯吸附等温式,其推导过程如下:
在多组分高分散的两相系统中,若用σ表示表面层,则
一定的温度与压力下,上式为 ![]()
![]() (19)
(19)
保持![]() 和
和![]() 不变,积分上式得
不变,积分上式得
![]()
![]() 为状态函数。具有全微分性质,故
为状态函数。具有全微分性质,故
![]() (20)
(20)
比较(19)和(20)两式得到表面层的吉布斯-杜亥姆公式:
![]() (21)
(21)
或 ![]()
对于由溶质和溶剂组成的二组分系统,用1表示溶剂,2表示溶质,则
![]() (22)
(22)
溶液本体的吉布斯-杜亥姆公式为
![]()
或 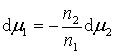
当溶液表面吸附达平衡时,各组分在表面层和在本体中的化学势相等,即
![]()
![]()
所以 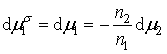
![]()
将上面二式代入式(22)整理后可得
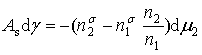 (23)
(23)
令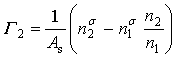 ,其意义为:单位面积的表面层所含溶质的物质的量(
,其意义为:单位面积的表面层所含溶质的物质的量(![]() )与在溶液本体中相同数量的溶剂所含溶质物质的量(
)与在溶液本体中相同数量的溶剂所含溶质物质的量(![]() )的差值,称为溶质的表面过剩量,也称作溶质的表面吸附量。将Г2代入式(23)得
)的差值,称为溶质的表面过剩量,也称作溶质的表面吸附量。将Г2代入式(23)得
 (24)
(24)
又因为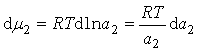 ,所以
,所以
![]() (25)
(25)
此即吉布斯吸附等温式。
对于稀溶液,可以用溶质的浓度代替活度,并略去Г2和a2中的下标2,吉布斯公式为
![]() (26)
(26)
由吉布斯公式可知,若![]() ,则Г>0,表明凡增加浓度使表面张力降低的溶质必然在表面层发生正吸附;若
,则Г>0,表明凡增加浓度使表面张力降低的溶质必然在表面层发生正吸附;若![]() ,则Г<0,表明凡增加浓度使表面张力增大的溶质必然在表面层发生负吸附;若
,则Г<0,表明凡增加浓度使表面张力增大的溶质必然在表面层发生负吸附;若![]() ,则Г=0,即无吸附作用。
,则Г=0,即无吸附作用。
在一定温度下,测定不同浓度c时的表面张力![]() ,以
,以![]() 对c作图,求得曲线上各指定浓度时的斜率,即为该浓度下的
对c作图,求得曲线上各指定浓度时的斜率,即为该浓度下的![]() 之值,再利用式(11.26)即可计算出相应的吸附量Γ。
之值,再利用式(11.26)即可计算出相应的吸附量Γ。
例4 设稀油酸钠水溶液的表面张力与溶质活度呈线性关系![]() ,式中
,式中![]() 为纯水表面张力,b为常数。已知298K时
为纯水表面张力,b为常数。已知298K时![]() ,
, ![]() ,试计算该液中油酸钠的表面过剩量。
,试计算该液中油酸钠的表面过剩量。
解 根据吉布斯吸附公式
![]()
已知 ![]() ,
,
则 ![]()
所以
![]()
![]()
四、表面吸附量与溶液浓度的关系
利用希什科夫斯基经验式(18),将γ对浓度c求导,可得
![]()
代入吉布斯公式即得Г与c的关系为
![]() (27)
(27)
当c很小,即c<<K时,K+c≈K,则
![]()
式中a=bγ0/2.303RTK,表明此时Г与c成正比;当c足够大,即c>>K时,K+c≈c,则
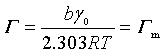 (28)
(28)
此时表面吸附量为一常数,再增加浓度,吸附量也不再改变,表示吸附已达饱和,Гm为饱和吸附量。结合以上两种极限情况,吸附量与浓度的关系可用图11.12表示。

五、表面活性分子在两相界面上的定向排列
由Г与c的关系可知,当表面活性物质的浓度达一定值后,吸附达饱和,此时Гm=bγ0/2.303RT为一常数。既然同系物具有相同的b值,那末它们必然具有相同的饱和吸附量。实验结果表明,直链的脂肪酸、醇和脂肪胺类,只要含碳数目不超过8,则不管碳链长度如何,Гm值都相同。因不同链长的同系物分子的横截面积相同,可想而知,达饱和吸附时,这些表面活性分子一定是紧密地立着定向排列的,极性基伸入水中,非极性基暴露在空气中,形成一层单分子膜,如图13。这种由可溶于水的表面活性物质在液面上定向排列形成的单分子膜,称作可溶性单分子膜,或吸附膜。
当溶液达到饱和吸附时,表面层浓度很大,即 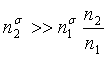 ,本体中表活性物质的浓度与表面层相比,可以忽略不计。因此,可以把饱和吸附量近似地看作是表面层表面活性物质的浓度,即单位表面上的溶质的物质的量,表示为
,本体中表活性物质的浓度与表面层相比,可以忽略不计。因此,可以把饱和吸附量近似地看作是表面层表面活性物质的浓度,即单位表面上的溶质的物质的量,表示为
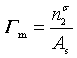
则单位表面上溶质的分子数为ГmL,L为阿佛加德罗常量。因而每个分子所占有的面积,即每个分子的截面积S为
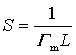 (29)
(29)
表面活性分子在界面上的定向排列不只限于气—液界面,在液—液、固—液和固—气界面上也都有类似的情况。分子在界面上的定向排列显著地影响着表面的性质,这在实际上有许多重要的应用,例如改变固体表面的润湿性能、稳定乳状液与泡沫等。
