一、 基本内容
(一)表面功、表面吉布斯自由能和表面张力
在温度、压力及组成恒定的条件下,可逆地使表面积增加dA时,环境对系统所做的非体积功称为表面功,并表示为
![]()
该条件下的可逆非体积功应等于系统吉布斯自由能的增加,即![]() ,因此可得
,因此可得
![]()
该式表明,等温、等压下,若dA<0,则dG<0,即表面积减小的变化是自发的。
上式又可写作
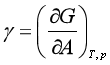
![]() 表示单位表面上,表面层的分子比相同数量的内部分子多余的吉布斯自由能,称作比表面吉布斯自由能,通常称作表面吉布斯自由能。其单位为J·m-2。
表示单位表面上,表面层的分子比相同数量的内部分子多余的吉布斯自由能,称作比表面吉布斯自由能,通常称作表面吉布斯自由能。其单位为J·m-2。
![]() 又是表面周界单位长度上所受的使表面收缩的力,称为表面张力,它垂直作用于表面的周界,与表面相切,使表面收缩。其单位为N·m-1。通常情况下,表面张力随着温度的升高而降低。
又是表面周界单位长度上所受的使表面收缩的力,称为表面张力,它垂直作用于表面的周界,与表面相切,使表面收缩。其单位为N·m-1。通常情况下,表面张力随着温度的升高而降低。
表面张力和表面吉布斯自由能的物理意义不同,单位不同,但量值相同。在讨论界面热力学性质时,![]() 作为表面吉布斯自由能使用,在讨论界面间的相互作用及平衡关系时,
作为表面吉布斯自由能使用,在讨论界面间的相互作用及平衡关系时,![]() 作为表面张力使用。
作为表面张力使用。
(二)弯曲表面的附加压力
由于表面张力的作用,弯曲表面下的液体或气体受到一附加压力ps,凸面液体所受压力比平面液体大,而凹面液体所受压力则比平面液体小。ps与液体的曲率半径有关,当液面可视为球形时,ps的数值与曲率半径Rˊ的关系为
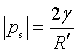
式中![]() 为液体的表面张力。
为液体的表面张力。
该式表明,对于指定液体,弯曲表面的附加压力与表面曲率半径成反比,其方向总是指向曲率中心;对于不同液体,当液面的曲率相同时,附加压力与液体的表面张力成正比。
(三)毛细管现象
由于液体对毛细管的润湿性能不同,管中液面可呈凹形或凸形曲面,因而受到不同方向的附加压力,导致液体在管内上升或下降一定高度h。h与液体的表面张力![]() 、密度
、密度![]() 、液体与毛细管壁的接触角θ以及毛细管半径r的关系为
、液体与毛细管壁的接触角θ以及毛细管半径r的关系为
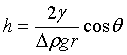
Δρ为液体与气体的密度差,通常可以忽略气体的密度。凹液面时,θ<90,h>0,毛细上升;凸液面时,θ>90°,h<0,毛细下降。
(四)弯曲表面上的蒸气压
由于弯曲表面的液体所受的实际压力与平面液体不同(除大气压之外还有附加压力),因此其蒸气压也与平面液体的蒸气压不同,开尔文公式表达了半径为Rˊ,表面张力为γ的弯曲表面蒸气压p′与平面液体蒸气压p0的关系
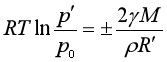
凸液面时,p′>p0,且R′越小,p′越大;凹液面时,p′<p0,且R′越小,p′越小。
(五)溶液的表面吸附
溶液的表面张力随溶质的性质及浓度而变化,所以溶液会自动调节表面层的浓度以尽量降低表面吉布斯自由能,导致溶液表面层的组成与本体溶液的组成不同,称这种现象为溶液的表面吸附。若溶质在表面层的浓度大于它在体相中的浓度,则为正吸附,反之为负吸附。
吉布斯吸附公式描述了溶质的表面吸附量Γ与溶质的活度和表面张力随溶质活度变化率之间的关系
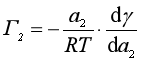
对于稀溶液,可用溶质的浓度代替活度,并可略去下角标,表示为
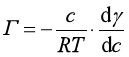
若![]() <0,则Γ>0,表明凡增加浓度使表面张力降低的溶质在表面层发生正吸附;若
<0,则Γ>0,表明凡增加浓度使表面张力降低的溶质在表面层发生正吸附;若 ![]() >0,则Γ<0,表明凡增加浓度使表面张力增大的溶质在表面层发生负吸附。
>0,则Γ<0,表明凡增加浓度使表面张力增大的溶质在表面层发生负吸附。
(六)液—液铺展
当液体B滴在不相溶的另一种液体A表面时,可能会形成一层薄膜覆盖在A的表面,这种现象称作液体B在液体A表面的铺展。定义铺展系数
![]()
式中γA、γB及γAB分别为液体A、B的表面张力及A-B间的界面张力。若SB/A>0,则B能在A表面铺展;若SB/A<0,则B不能在A表面铺展。
某些难溶的有机液体能在水的表面铺展成单分子膜,称之为不溶性表面膜。展开的表面膜能对水中的漂浮物体产生推动力,人们将膜对单位长度的浮物所施的力称为表面压![]() ,并经热力学分析可得到
,并经热力学分析可得到
![]()
γ0为纯水的表面张力,γ为铺膜后水的表面张力。该式表明,表面压等于因铺膜而使水的表面张力的降低值。
(七)液体对固体表面的润湿作用
液体与固体接触时,随着液体和固体自身表面性质及固—液界面性质的变化,可存在沾湿、浸湿及铺展三种润湿情况,并分别用黏附功、浸湿功及铺展系数来判断。
黏附功 ![]()
浸湿功 ![]()
铺展系数 ![]()
Wa≥0时,液体能沾湿固体;Wi≥0是液体浸湿固体的条件;Sl/s≥0,液体可以在固体表面上自动铺展。
由于γl-g及γs-l尚不能由实验直接测定,所以上述判据并不实用。习惯上人们根据接触角来判断液体对固体的润湿程度。
接触角与各界面张力的关系可表示为
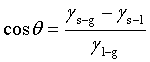
θ>90°为不润湿,θ<90°为润湿,θ=0°为完全润湿,θ=180°为完全不润湿。将上式与黏附功、浸湿功及铺展系数的定义式相结合可得
![]()
![]()
![]()
以上三式为沾湿、浸湿和铺展过程的接触角判据。
(八)表面活性剂的结构、性质及应用
能显著降低水的表面张力的物质称作表面活性剂,它们都是由亲水基团和亲油基团构成的两亲性分子。通常将表面活性剂划分为四大类:阴离子型、阳离子型、两性及非离子型表面活性剂。
表面活性剂的亲水亲油性用亲水亲油平衡值(HLB)来表征,HLB值越小,亲油性越强,反之亲水性强。不同的HLB值范围具有不同的作用。
表面活性剂在水溶液中达到一定浓度时,会在溶液中自动地形成定向排列的聚集体—胶束,开始形成胶束的浓度为临界胶束浓度(cmc)。表面活性剂溶液的许多性质都在cmc附近发生转折性变化。
表面活性剂能在溶液表面定向排列和在溶液中形成胶束的两大特点,决定了它们具有很多不可替代的作用,例如改变润湿性能、增溶、乳化、起泡、去污、抗静电等等,因而在工农业生产、日常生活及科学研究中具有广泛的应用。
(九)气固吸附
固体表面的分子由于受力不均而具有剩余力场,能对气体分子产生吸引力,使气体在固体表面聚集,从而降低固体的表面吉布斯自由能,这种现象为气固吸附。气固吸附按照吸附力的性质分类,吸附力为范德华力的为物理吸附,吸附力为化学键力则为化学吸附。由于吸附力的性质不同,因而两类吸附在吸附热的大小、吸附选择性、吸附稳定性等多方面表现出不同的特征。
气固吸附时,被吸附的气体叫做吸附质,吸附气体的固体叫做吸附剂。吸附量q通常用单位质量的吸附剂所吸附的气体在标准状况下的体积表示
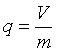
一定温度下,反映吸附量与吸附质平衡分压关系的曲线为吸附等温线,常见的吸附等温线有五种类型。朗格缪尔从吸附动态平衡的基本观点出发,提出了在均匀固体表面、吸附分子间无相互作用、只发生单分子层吸附情况下的吸附理论,并推导出朗格缪尔吸附等温式
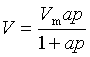
式中V是气体压力为p时的吸附量,Vm为固体表面铺满单分子层时的饱和吸附量,a是吸附平衡常数。
上式可整理成
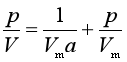
以p/V对p作图,得一直线,并可由直线的斜率和截距求得Vm和a。
朗格缪尔等温式代表了单分子层吸附的规律,是一个理想的吸附公式,但只能对第Ⅰ类吸附曲线作出解释。在此基础上发展起来的BET理论,提出了多分子层吸附公式,称为BET公式
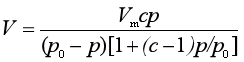
式中p0是实验温度下气体的饱和蒸气压,c是与吸附热有关的常数。若将上式改写成直线方程的形式,则可由斜率和截距求得Vm和c 。
BET公式的一个重要用途是测定固体的比表面积。
二、 重点与难点
(一)表面张力
表面张力是界面化学领域中最基本的概念,它是研究界面热力学和界面平衡的基础。引出表面张力的传统方法是先定义表面功,再由表面功与表面吉布斯自由能的关系得到比表面吉布斯自由能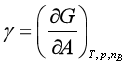 ,然后从表面功的力学定义得到γ又是单位长度的表面周界所受到的使表面收缩的力,因此γ又称表(界)面张力。
,然后从表面功的力学定义得到γ又是单位长度的表面周界所受到的使表面收缩的力,因此γ又称表(界)面张力。
由于界面张力是一种客观存在的宏观力,所以也可以根据界面层分子受力不均,有离开界面层进入体相的趋势,其宏观表现为界面的周界受到使界面收缩的力,由此直接定义界面中单位长度的收缩张力为界面张力。对于液气或固气界面,又称表面张力。
由于界面张力的存在,界面热力学的基本方程式应为以下形式
![]()
![]()
![]()
![]()
由以上四式可得
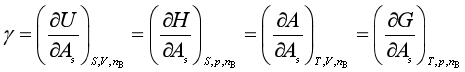
由此可知,界面张力与一定条件下单位界面的热力学能、焓、亥姆霍兹函数及吉布斯函数相联系,体现了γ的更为广泛的意义。
界面张力由界面层分子受到的不均衡力(净吸力)引起,但二者的性质及方向均不相同。净吸力是一种微观力,其方向指向体相内部;界面张力是一种宏观力,是微观净吸力的宏观表现,其方向与界面相切,垂直于边界,使界面收缩。
界面张力的大小取决于物质的本性、组成、相邻相的性质及温度、压力等。物质内部质点间的作用力越强,界面张力越大,因此固体的表面张力远大于通常液体的表面张力,但固体表面不易收缩并难以流动,所以目前尚无法直接测定固体的表面张力和固液界面张力。液体表面张力的数据是指液体与饱和了自身蒸气的空气达平衡时的界面张力值,一般情况下,液体的表面张力随温度升高而减小。界面张力是可以测量的强度性质。
(二)弯曲界面的附加压力及其后果
弯曲界面上界面张力的存在,使弯曲界面下的液体受到一个附加压力ps。当界面为球形时,ps值与曲率半径成反比,其方向总是指向曲率中心。
由于液体与毛细管壁的润湿性不同,毛细管中的液体会呈现弯曲的凸形或凹形液面,并产生不同方向的附加压力。在附加压力的作用下,液体会在毛细管中上升或下降,上升或下降的高度h与液体的表面张力、液体的密度及弯曲液面的曲率半径有关。利用已知半径的均匀毛细管,通过测定h值可以求得液体的表面张力,这是一种常用的测量液体表面张力的方法。
由于存在附加压力,弯曲表面下的液体所受的压力与平面液体不同,导致弯曲液面上方的蒸气压也与平面液体的蒸气压不同。开尔文公式描述了液体的饱和蒸气压随表面曲率变化的关系:凸面液体的蒸气压大于平面液体的蒸气压,并随液面曲率半径的减小而增大;凹面液体的蒸气压小于平面液体的蒸气压,并随液面曲率半径的减小而减小。开尔文公式同样适用于微小晶体的饱和蒸气压,当晶体粒度变小时,蒸气压同样升高,进而导致微小晶体的溶解度增大,熔点降低。利用开尔文公式可以解释各种亚稳状态的存在,例如过饱和蒸气、过热或过冷液体、过饱和溶液等。
(三)溶液的表面吸附量
溶液的表面吸附量是另一个可测量的界面相的强度性质,它代表单位表面上所含溶质的物质的量与具有相同数量溶剂的本体溶液中所含溶质的物质的量的差值,是相对于溶剂的表面超量为零时溶质的表面超量。吉布斯吸附等温式表达了溶液的表面吸附量与界面张力随溶质浓度变化率之间的关系。若溶液的表面张力随溶质浓度的增大而增大(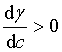 ),则表面吸附量为负值,即发生负吸附;若增加溶质浓度使溶液表面张力降低(
),则表面吸附量为负值,即发生负吸附;若增加溶质浓度使溶液表面张力降低(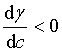 ),则发生正吸附。电解质溶液的表面发生负吸附,而具有表面活性的物质形成溶液时,则发生正吸附。
),则发生正吸附。电解质溶液的表面发生负吸附,而具有表面活性的物质形成溶液时,则发生正吸附。
表面活性剂能显著降低水的表面张力,当其浓度超过一定值时,能在溶液表面达到饱和吸附,此时表面活性剂分子在表面上定向排列形成单分子层吸附膜。饱和吸附量可以近似看作表面浓度,并可由此近似求得表面活性剂分子的截面积及链长。
原则上,吉布斯吸附等温式适用于任意两相界面,但因固体表面张力及固液界面张力难以测定,所以主要应用于液体表面和液液界面。
(四)接触角
将少量液体滴在固体表面时,会形成一定形状的液滴,在液滴的投影图像上,在气、液、固的三相交界处,气液界面张力与固液界面张力之间的夹角(含液体在内),称为接触角,它的大小取决于三种界面张力的相对值。人们规定θ<90°时,液体能润湿固体,θ>90°时,液体不能润湿固体。
从热力学角度,润湿分为沾湿、浸湿与铺展三种情况,并分别用黏附功、浸湿功及铺展系数判断润湿程度。应该注意润湿的热力学判据与习惯上采用的接触角判据的区别,例如当 90°<θ<180°时,由![]() 可知,此时
可知,此时![]() >0可发生沾湿现象,属于润湿的情况之一。但因θ>90°,习惯上判定为不润湿。此时两种判据是不统一的,我们必须注意这种区别,明确θ>90°时,虽然由接触角的习惯判据判断为不润湿,但从热力学分析可知,此时固液接触时,仍使体系的吉布斯自由能降低。
>0可发生沾湿现象,属于润湿的情况之一。但因θ>90°,习惯上判定为不润湿。此时两种判据是不统一的,我们必须注意这种区别,明确θ>90°时,虽然由接触角的习惯判据判断为不润湿,但从热力学分析可知,此时固液接触时,仍使体系的吉布斯自由能降低。

