试题样式一答案
一、填空题(每题2分,计20分。)
1、热;力
2、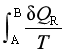 ;等温变化
;等温变化
3、偏摩尔热力学能;化学势
4、物种;化学平衡限制条件
5、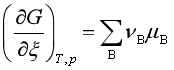 ;
;![]()
6、稳态;平衡
7、<; <
8、一; 二
9、辅助;参比
10、![]() ;
; ![]()
二、单项选择题(每题2分,计30分。)
1、A 2、C 3、C 4、D 5、B
6、B 7、A 8、A 9、D 10、C
11、D 12、D 13、A 14、B 15、A
三、判断题(每题2分,计20分。)
1、√ 2、√ 3、× 4、√ 5、×
6、× 7、× 8、√ 9、× 10、√
四、简答题(每题5分,计20分。)
1、不对。正确的说法是:“绝热系统或孤立系统中,可逆过程中系统的熵不变,不可逆过程的嫡增大。”
2、查表可知水的饱和蒸气压65.8 kPa时温度为89 ℃。青藏高原,加热到89 ℃水就沸腾,一般锅中水温不能超过89 ℃,所以生米不能煮成熟饭,高压锅是密封的,加热时,蒸汽出不来,水而上压力增大,蒸汽压开高,水的沸点就升高,一般压力锅可以使水的沸点升高到110~120 ℃,当然容易把饭煮熟了。
3、错误的。一个化学反应进行完全所需的时间比半衰期的两倍要长的多,不是半衰期的两倍。例如一级反应,反应时间为半衰期两倍时,反应物才消耗四分之三。本题的说法只适用于零级反应。
4、联系电化学与热力学的主要桥梁:![]() ,
,![]() 是热力学中化学反应自由能变化,E是电池电动势,因为热力学中
是热力学中化学反应自由能变化,E是电池电动势,因为热力学中![]() 、
、![]() 是通过可逆过程计算的,研究热力学需要的是可逆过程,用电化学研究热力学必须要引入可逆电池概念,可逆电池也是一个热力学概念概念。
是通过可逆过程计算的,研究热力学需要的是可逆过程,用电化学研究热力学必须要引入可逆电池概念,可逆电池也是一个热力学概念概念。
五、计算题(每题5分,计10分。)
1、解:该溶液可视为理想稀溶液,则有
![]()
先由上式计算97.11℃时乙醇溶在水中的亨利系数,
即 101.3 kPa = 91.3 kPa(1-0.0300) + kx,乙醇×0.0300
解得 kx,乙醇= 425 kPa , 于是求得当x乙醇= 0.0200时
p乙醇 = kx,乙醇x乙醇
= 425 kPa×0.0200
= 8.5 kPa
p水 = p*水x水
= 91.30 kPa×(1-0.0200)
= 89.5 kPa
2、解:设邻-![]() 和对-
和对-![]() 在反应到30
在反应到30![]() 时浓度分别为
时浓度分别为![]() 和
和![]()
![]()
![]()
![]()
平行反应的特点 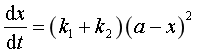
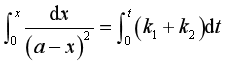
积分得 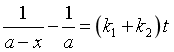
所以 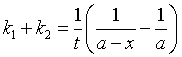
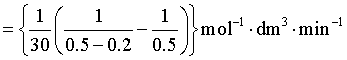
![]()
![]()
解得
![]()
![]()