|
克劳修斯-克拉贝龙方程
对于正常相变,两相自由能变化 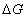 =0,
由于 =0,
由于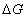 是相平衡温度和压力的函数,即 是相平衡温度和压力的函数,即 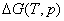 =0。所以单组分体系处于两相平衡时,温度和压力应满足一定的函数关系,而这种函数关系正是克拉贝龙方程所反映的内容。 =0。所以单组分体系处于两相平衡时,温度和压力应满足一定的函数关系,而这种函数关系正是克拉贝龙方程所反映的内容。
设单组分B在T,p时处于α和β两相平衡,即
T,p 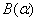  B(β) B(β)
根据等温等压相平衡条件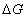 =0 可得 =0 可得
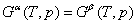
若温度改dT,相应地压力改变dp时,两相仍维持平衡,则
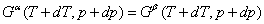
上两式相减,得 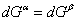
由热力学的基本关系式,得
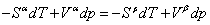
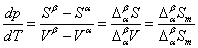
正常相变时,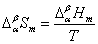 则 则
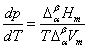
此式即称为克拉贝龙(Clapeyron)方程式。它表明单组分体系处于两相平衡时,压力随温度的变化率与相变焓成正比,与温度和相变体积的乘积成反比。该式适用于纯物质的任何两相平衡(如液-气,液-固,固-固平衡等)体系。例如对液-气两相平衡为
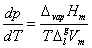
若液相的体积与气相的体积相比可忽略不计,且气相视为理想气体,即
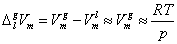 代入上式,得 代入上式,得
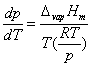 整理可得 整理可得
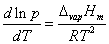
此式称为克劳修斯(Clausius)-克拉贝龙(Clapeyron)方程式。
|