液体表面层分子和内部(本体)分子受力情况不同。下图是与蒸气呈平衡的纯液体(图中圆圈代表分子的引力范围),内部分子(图中A)受到周围液体分子的作用力相互抵消,合力为零。而表面层分子(图中B,C)受到液相和气相分子引力,合力指向液体内部,要使液体内部分子移到表面层(使液体的表面积增大),就必须克服此吸引力作功。
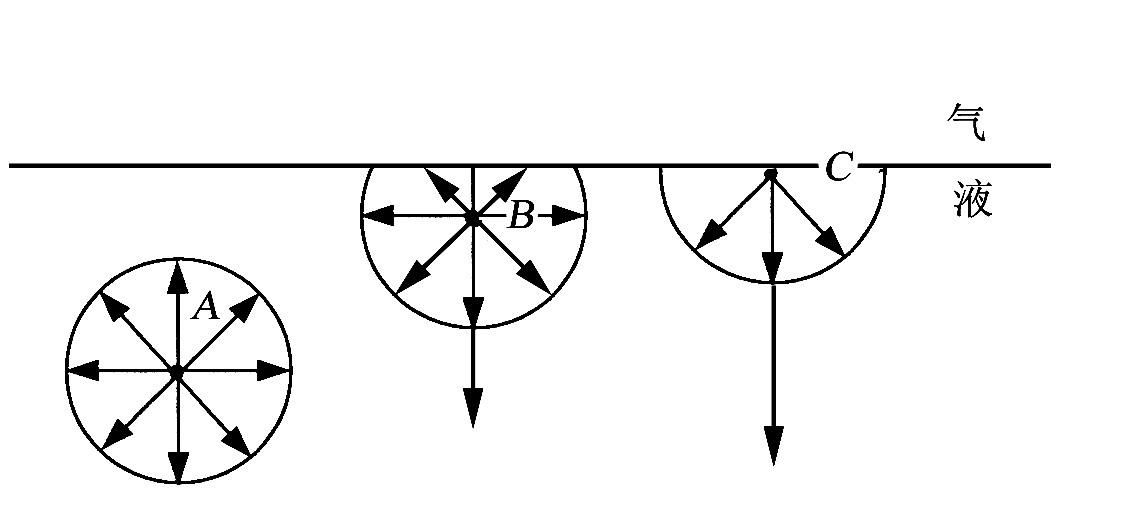
图10-1 液体分子的受力情况
在恒温恒压下可逆地增加液体表面积,体系自由能的改变为:
 (推导) (推导)
则 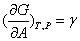
式中γ是增加单位表面积时所需的可逆功,也就是单位面积的表面层分子比相同数量的内部分子多出的自由能,称为比表面自由能,单位为J·m-2。
由于表面层分子受到内部分子的引力,因而表面层分子有自动进入液体内部的倾向。在宏观上表现为有一个与表面平行,力图使表面收缩的力。从这个角度来理解γ的物理意义时,γ又称为表面张力,单位N·m-1。表面张力γ的大小与液体的本性、共存气相、温度和压力有关。当温度升高时,表面张力下降,当达到临界状态时,表面张力趋于零。
当液体中加入某种溶质形成溶液后,溶剂的表面张力会升高或降低。若加入溶质使溶液的表面张力降低,则表面层中溶质的浓度大于溶液本体的浓度;反之,若使溶液的表面张力增加,则表面层中溶质的浓度小于溶液本体的浓度。当然,表面层与溶液本体的浓度差又会引起溶质分子的扩散,当这两种相反的趋势达到平衡时,溶液表面层与溶液本体的组成不同,这种现象称为溶液的表面吸附。在一定的温度和压力下,溶液的表面吸附量与溶液的表面张力和浓度有关。对于二组分稀溶液,它们之间的关系可用吉布斯(Gibbs)公式表示:
Γ 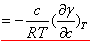 (推导) (推导)
式中Γ为表面吸附量,γ为表面张力,c为溶液浓度,T为热力学温度,R为气体常数。
若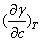 <0时,则Γ>0,称为正吸附。反之, <0时,则Γ>0,称为正吸附。反之,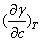 >0,则Γ<0,称为负吸附。从上式可以看出,只要测定溶液表面张力与浓度的等温曲线γ=f ( c ) ,通过曲线的斜率即可求得各浓度下溶液的表面吸附量Γ。 >0,则Γ<0,称为负吸附。从上式可以看出,只要测定溶液表面张力与浓度的等温曲线γ=f ( c ) ,通过曲线的斜率即可求得各浓度下溶液的表面吸附量Γ。
对于单分子吸附,其吸附量Γ与浓度c之间的关系可用朗格缪尔(Langmuir)等温吸附方程表示,即:
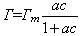
式中Гm为 饱和吸附量,a为吸附平衡常数。将此式两边取倒数可整理成线性方程:
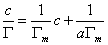
以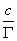 对c作图应为一直线,其斜率 对c作图应为一直线,其斜率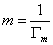 ,若以N代表饱和吸附时单位表面层中的分子数,则 ,若以N代表饱和吸附时单位表面层中的分子数,则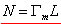 (推导)。L为阿佛加德罗常数。在饱和吸附时,每个被吸附分子在表面上所占的面积,即分子的截面积S为: (推导)。L为阿佛加德罗常数。在饱和吸附时,每个被吸附分子在表面上所占的面积,即分子的截面积S为:
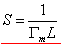 (推导) (推导)
若已知溶质的密度ρ,摩尔质量M,就可计算出吸附层厚度,即分子的长度δ
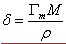 (推导) (推导)
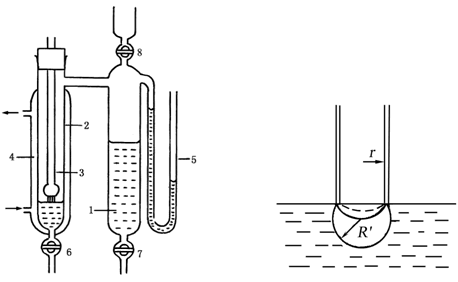
图 10-2 表面张力测定装置
图10-3 气泡形成过程
1-减压装置;2-样品管;3-毛细管;
4-恒温夹套;5-压力计;6、7、8-活塞
本实验利用最大气泡压力法测定液体的表面张力,其测量装置如图10-2所示。将待测表面张力的液体装入样品管2中,通过活塞6调节液面与毛细管3端面相切,则液面沿毛细管上升。开活塞7使体系缓慢减压,此时由于毛细管内液面上方的压力(即外压)大于样品管中液面的压力,故毛细管内的液面逐渐下降,当液面至管口时便形成气泡逸出。此时压力计5的压力差ΔP即为待测液体在毛细管中所受的附加压力,即
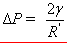 (推导) (推导)
式中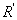 为气泡的曲率半径,因毛细管半径很小,所以形成的气泡基本上是球形。气泡刚形成时表面几乎是平的,此时曲率半径 为气泡的曲率半径,因毛细管半径很小,所以形成的气泡基本上是球形。气泡刚形成时表面几乎是平的,此时曲率半径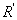 中最大(如图10-3所示);当气泡形成半球形时, 中最大(如图10-3所示);当气泡形成半球形时,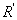 与毛细管半径r相等,曲率半径达最小值,此时ΔP为最大值。随着气泡的进一步增大, 与毛细管半径r相等,曲率半径达最小值,此时ΔP为最大值。随着气泡的进一步增大,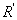 又趋增大,直至逸出液面。在此过程中,最大附加压力 又趋增大,直至逸出液面。在此过程中,最大附加压力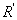 可以用压力计5的最大液柱差Δ hm来表示。则 可以用压力计5的最大液柱差Δ hm来表示。则
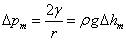
式中ρ为压力计内介质的密度,g为重力加速度,由上式得
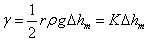
式中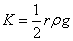 称为仪器系数。用已知表面张力的溶液作为标准,由实验测定 称为仪器系数。用已知表面张力的溶液作为标准,由实验测定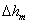 ,由上式求出K。本实验以水作为标准, ,由上式求出K。本实验以水作为标准,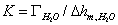 ,则待测液体的表面张力的计算式为 ,则待测液体的表面张力的计算式为
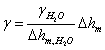
|