| [实验关键提示]
本实验的关键是样品能否燃烧(尤其是萘)。为确保点火成功,应注意下面几点:
(1)点火丝与电极接线柱的连接要牢固,点火丝的两头切勿与氧弹的内壁及坩埚接触,点火丝中间下凹的最低处与样品之间的距离以0.5厘米左右为宜。
(2)压片时不要用力过大。因为样品太硬不易被引燃,样品压片的硬度应以用手稍用力即可破碎为宜。另外,平时样品应保存于干燥器中,如果样品受潮则不易燃烧且使称量有误。
(3)为确保点火的成功率,也可在样品片上加一小条已知燃烧焓的棉线,或考虑使用两根点火丝。另外,氧弹的充氧量应确保在3 MPa左右。从安全方面考虑,氧气钢瓶的使用要在教师的指导下进行。
此外,为避免人为因素造成的实验误差,在苯甲酸和萘的两次测定中,量筒的取水量应尽量保持一致。外筒水温应尽量接近室温,燃烧后内筒水温应比外筒水温高出0.7~1 K左右。以便使燃烧终点时内筒水温出现明显的下降。
[讨论]
关于化学反应热的测量已有悠久的历史,它为后来热力学理论的建立奠定了实验基础。如今,对于这方面工作的系统研究,已成为物理化学的一个分支——热化学。
物质的燃烧焓数据广泛用于各种热化学计算中,是化学热力学中常用的基本数据。从原则上讲,有了物质的标准摩尔生成焓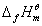 数据就可以解决问题了,然而有些物质不能从单质直接合成;而另一方面,一些有机物的燃烧焓却比较容易测定,它们的标准摩尔燃烧焓 数据就可以解决问题了,然而有些物质不能从单质直接合成;而另一方面,一些有机物的燃烧焓却比较容易测定,它们的标准摩尔燃烧焓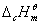 数据已有表可查。本实验所测定的摩尔燃烧焓 数据已有表可查。本实验所测定的摩尔燃烧焓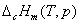 与298 K和 与298 K和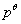 状态下的 状态下的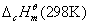 的换算可利用下式: 的换算可利用下式:
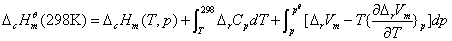
式中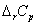 、 、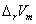 分别为燃烧反应前后的定压热容差和体积差。由于燃烧焓本身是一个很大的数值,因此当实验温度T接近298 K时,这种换算往往意义不大。 分别为燃烧反应前后的定压热容差和体积差。由于燃烧焓本身是一个很大的数值,因此当实验温度T接近298 K时,这种换算往往意义不大。
应当指出的是,在利用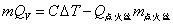 公式计算时,可不考虑点火丝的影响,仅利用 公式计算时,可不考虑点火丝的影响,仅利用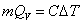 一式即可。这主要基于以下两点:其一是 一式即可。这主要基于以下两点:其一是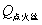 和 和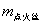 与样品相比均较小;其二是在苯甲酸和萘的两次计算时,可以相互抵消一部分点火丝的影响。例如,0.5 g苯甲酸的 与样品相比均较小;其二是在苯甲酸和萘的两次计算时,可以相互抵消一部分点火丝的影响。例如,0.5 g苯甲酸的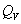 为13230 J,本实验使用的点火丝质量为0.0086 g,完全燃烧放热为28 J,仅占苯甲酸热量的0.2%。 为13230 J,本实验使用的点火丝质量为0.0086 g,完全燃烧放热为28 J,仅占苯甲酸热量的0.2%。
氧弹中少量的N2与O2反应生成硝酸并溶于水,也能放出少量的热量,因而使测量结果产生误差。对于精确的量热实验,其校正方法是用NaOH溶液滴定产生的硝酸,每毫0.1mol-1·dm-3的滴定液相当于产生5.78 J的热量。
量热技术是物理化学的一项重要实验技术。近年来,在测量方法、技术以及仪器设备方面都有较大发展。对于有气体参加且放热较大的化学反应(如燃烧反应),通常用弹式量热计进行测量,其量热手段是通过高精度的温差测量实现的。而温差的测量多采用雷诺(Renolds)温差校正法。希望同学们能够理解并掌握。
萘在298 K时标准摩尔燃烧焓的文献值为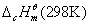 =-5157 kJ·mol-1。同学们可将实验测量结果与之比较,分析产生误差的原因。 =-5157 kJ·mol-1。同学们可将实验测量结果与之比较,分析产生误差的原因。
|