|
燃烧焓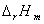 是热化学中重要的基本数据,它是指单位物质的量的物质与氧气完全燃烧生成规定的燃烧产物时的反应焓(变)。 所谓规定的燃烧产物是指C变成CO2(气)、H变成H2O(液)、S变成SO2(气)、N变成N2(气)、Cl变成HCl水溶液等。例如,甲烷在298K时的标准摩尔燃烧焓为: 是热化学中重要的基本数据,它是指单位物质的量的物质与氧气完全燃烧生成规定的燃烧产物时的反应焓(变)。 所谓规定的燃烧产物是指C变成CO2(气)、H变成H2O(液)、S变成SO2(气)、N变成N2(气)、Cl变成HCl水溶液等。例如,甲烷在298K时的标准摩尔燃烧焓为:
CH4(g)+2O2(g)→ CO2(g)+2H2O(l) 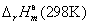 = -890.31kJ·mol-1 = -890.31kJ·mol-1
对于燃烧焓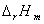 的测定来源于量热实验,所依据的是热力学公式: 的测定来源于量热实验,所依据的是热力学公式:
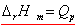 (推导) (推导)
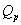 是反应在恒压条件下测量的恒压热。对于燃烧反应,实验要在恒容容器中进行,所测量的是反应的恒容热 是反应在恒压条件下测量的恒压热。对于燃烧反应,实验要在恒容容器中进行,所测量的是反应的恒容热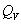 。由于 。由于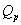 和 和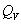 的测量条件不同,需按下式进行换算: 的测量条件不同,需按下式进行换算:
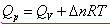 (推导) (推导)
式中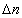 为气体产物与气体反应物的物质的量之差,R为摩尔气体常数,T为反应的热力学温度。 为气体产物与气体反应物的物质的量之差,R为摩尔气体常数,T为反应的热力学温度。
本实验是利用量热计来测定萘(C10H8)的燃烧热,所测得的是恒容热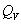 。
量热计测量的原理是将一定量的待测物质在氧弹中完全燃烧,燃烧时放出的热量使量热计的温度升高,通过测量燃烧反应前后此温度的变化值,就可以计算出该样品的 。
量热计测量的原理是将一定量的待测物质在氧弹中完全燃烧,燃烧时放出的热量使量热计的温度升高,通过测量燃烧反应前后此温度的变化值,就可以计算出该样品的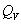 。其计算式为: 。其计算式为:
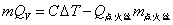
式中m为待测物质的质量,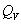 为待测物质的恒容热, 为待测物质的恒容热,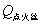 为点火丝的恒容热(本实验使用的是镍铬合金丝,其 为点火丝的恒容热(本实验使用的是镍铬合金丝,其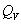 =3240 J·g-1); =3240 J·g-1);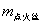 为点火丝的质量; 为点火丝的质量;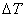 为样品燃烧前后量热计温度的变化值;C为量热计的热容量,它是指量热计(包括量热计中的水)温度升高单位温度时所吸收的热量。通常用已知 为样品燃烧前后量热计温度的变化值;C为量热计的热容量,它是指量热计(包括量热计中的水)温度升高单位温度时所吸收的热量。通常用已知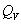 的物质标定量热计热容量C,一般采用高纯度的苯甲酸作为标准物质(其恒容热 的物质标定量热计热容量C,一般采用高纯度的苯甲酸作为标准物质(其恒容热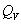 =26460J·g-1)。当已知量热计热容量C之后,就可以利用上式通过实验测定其它物质的恒容热。 =26460J·g-1)。当已知量热计热容量C之后,就可以利用上式通过实验测定其它物质的恒容热。
燃烧过程中量热计温度随时间变化的曲线如下图中的曲线abcd所示。其中ab段表示实验前期,b点相当于开始燃烧之点;bc段相当于燃烧反应期;cd段则为后期。由于量热计与周围环境之间有热量交换,所以曲线ab和cd常常发生倾斜,在量热实验中所测得的温度变化值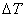 ,可以按如下方法确定(雷诺温差校正法):取b点所对应的温度 ,可以按如下方法确定(雷诺温差校正法):取b点所对应的温度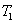 ,c点所对应的温度 ,c点所对应的温度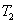 ,其平均温度 ,其平均温度 为 为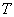 ;经过T点作横坐标的平行线TO与曲线abcd相交于O点;然后通过O点作垂线AB,该垂线与ab线和cd线的延长线分别交于E、F两点,则E、F两点所表示的温度差即为所求的燃烧前后温度的变化值 ;经过T点作横坐标的平行线TO与曲线abcd相交于O点;然后通过O点作垂线AB,该垂线与ab线和cd线的延长线分别交于E、F两点,则E、F两点所表示的温度差即为所求的燃烧前后温度的变化值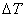 。图中EE'表示由环境辐射进来的热量所造成的温度升高,这部分是必须扣除的;而FF'表示因量热计向环境辐射出去的热量所造成的温度降低,这部分是必须加上的。经过上述温度校正所得的温度差EF表示了由于样品燃烧使量热计温度升高的数值。 。图中EE'表示由环境辐射进来的热量所造成的温度升高,这部分是必须扣除的;而FF'表示因量热计向环境辐射出去的热量所造成的温度降低,这部分是必须加上的。经过上述温度校正所得的温度差EF表示了由于样品燃烧使量热计温度升高的数值。
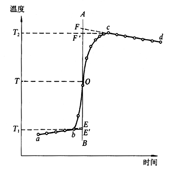
绝热较差时温差校正图
如果燃烧前量热计的水温稍低或量热计绝热性能较好,则反应后期的温度升高,在这种情况下的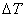 仍然按着上述方法进行校正。 仍然按着上述方法进行校正。
|