【实验关键提示】
本实验共测定五个温度下的乙醇的饱和蒸气压。人为因素造成的测定误差是影响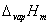 和 和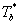 结果的主要原因。因此,在实验操作过程中应注意以下几点: 结果的主要原因。因此,在实验操作过程中应注意以下几点:
1、使恒温槽在恒温时具有较高的灵敏度。
2、要获得准确的饱和蒸气压数值,关键是要将等压计和样品池之间的空气彻底抽净。在抽气即将结束之前,可松开夹在冷凝管上的夹子,轻轻摇晃压力计,以加速空气的排出。而空气的排净与否,只能根据经验和从实验数据上判断。从经验上讲,20℃时乙醇的气液两相很快达到平衡,压力计内的两臂液面平齐后,不应该总发生变化,若发生变化,则表明空气没有被除净。从实验数据判断,20℃的数据应测定两次,两次相差0.27 kPa(2 mmHg)应在实验误差内,至少说明后一次测定时空气已被抽净。20 ℃时乙醇的饱和蒸气压的标准值为5.95 kPa (44.60 mmHg),可供参考。
3、在升温过程中,要及时向体系中放入空气,以保持等压计两液面平齐,不要等温度升高4 ℃后再放气,以免使等压计内的乙醇沸腾,使封闭液减少。
4、最初将样品加入样品池后,残留在等压计U型管内的乙醇要适量,以U型管体积的三分之二左右为宜。过多时会影响抽气,过少时乙醇很快被抽尽。另外,抽气速率要适中,避免抽气速率过快,等压计液体沸腾剧烈,乙醇很快被抽尽。
【讨论】
通过测定饱和蒸气压来计算摩尔气化焓,所依据的理论是克劳修斯——克拉贝龙方程,它是热力学的一个重要内容之一。从表面上看,液体的蒸气压和摩尔气化焓是两回事,但热力学却能把两者的内在联系揭示出来,从而使人们解决实际问题的能力大大提高。气化焓的直接测定属于量热技术,它需要复杂的设备和较高的实验技术(如实验2 燃烧焓的测定),且精确度不高,而蒸气压和温度的测定就容易得多,所以本实验提供了一种从蒸气压求算气化焓简便易行的方法。通过本实验可使学生加深对蒸发、冷凝和沸腾等概念的理解,懂得为什么在海拔高的山上煮鸡蛋不易熟,家用高压锅煮食物快,以及减压蒸馏的原理等等。不仅可以学会定性的分析,而且还可以学会做定量的计算。
从实验技术上讲,蒸气压的测定属于压力测定技术的范畴。本实验所介绍的静态法精确度较高,适合于低蒸气压物质的测定,即使蒸气压只有1333Pa (10mmHg) 左右也能测准。而动态法是测定液体在不同外压下的沸点,它的优点是对温度的控制要求不高,对低于100℃的液体可达到一定的精确度。除此之外,还有饱和蒸气流法,因其测定精确度较差,现在已很少使用。 导出克—克方程积分式的前提是假设摩尔气化焓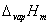 不随温度改变,这种假设在较大的温度区间内与实际情况有出入。若已知 不随温度改变,这种假设在较大的温度区间内与实际情况有出入。若已知 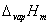 与温度T的函数关系,代入克—克方程微分式积分,便可得到一个更加精确的蒸气压与温度的方程,但这种方程形式复杂,计算繁琐,很少直接使用。目前最常用的是安托万(Antoine)经验方程: 与温度T的函数关系,代入克—克方程微分式积分,便可得到一个更加精确的蒸气压与温度的方程,但这种方程形式复杂,计算繁琐,很少直接使用。目前最常用的是安托万(Antoine)经验方程:
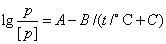
式中A、B和C都是物质的特性常数,称为安托万常数,几种物质的安托万常数见部分物理化学常用数据表。
通过对本实验原理的分析和实验现象的观察,可以发现许多有趣的问题,值得同学们讨论和思考。例如,在抽气过程中,等压计内的乙醇剧烈的沸腾,样品池内的乙醇是否也处于沸腾状态,若仔细观察的话会发现,如果本实验的空气未被抽净,则测得的蒸气压数据以及由此计算的正常沸点是偏高还是偏低?学生在操作过程中十分注意等压计两液面的平齐,以为少许的不平齐将产生实验误差,其实两液面少许的高度差对实验结果的影响是可以忽略的,因为乙醇的密度仅是水银密度的6%,1 cm的乙醇液柱高度差已足够大了,但折算成水银柱高度还不到0.1 mmHg。另外,当实验装置有少许的漏气现象,你应该能发现,但少许的漏气不影响实验测定,应该如何操作?如果学生在放气时,将气体放多了而使等压计两液面不平齐时,但空气尚未进入样品池内,可有两种方法解决,请说出这两种方法。
|