|
【实验关键提示】
根据前面的实验原理可以知道,要获得准确真实的相图,必须保证样品组成和测量温度的准确性,为此在实验过程中需注意以下几点:
1、样品的组成是直接称重配成的,要保证样品的纯度,一般化学纯可以满足实验要求。为防止样品在高温下的挥发氧化,在配制样品时加入了少量的石墨粉,尽管如此,长期使用的样品难免发生氧化变质,可以将样品废弃,重新配制。
2、加热熔化样品时的最高温度比样品熔点高出50℃左右为宜,以保证样品完全熔融。待样品熔融后,可轻轻摇晃样品管,使体系的浓度保持均匀。
3、在样品降温过程中,必须使体系处于或接近于相平衡状态,因此要求降温速率缓慢、均匀。降温速率取决于体系与环境间的温差、体系的热容量和热传导速率等因素。当固体析出时,产生的凝固热使步冷曲线出现“拐点”,若产生的凝固热能够抵消散失热量的大部分,则“拐点”明显;反之,则不明显。但降温速率太慢,实验时间延长。在本实验条件下,通过调整适当的风量以每分钟3~5 ℃的速率降温,可在较短时间内完成一个样品的测试。
4、样品在降温至“平阶”温度时,会出现十分明显的过冷现象,应该待温度回升出现“平阶”后,温度再下降时,才能结束记录。另外,为了使热电偶指示温度能真实地反映被测样品的温度,本实验所设计的热电偶套管的底部正好处于样品的中部,所用热电偶的热容量小,具有较好的导热性。
【讨论】
本实验和“实验4”同属二组分体系相图,它是相平衡的重要内容之一。相图突出的特点是直观性和整体性,通过相图可以得知在压力恒定时的某温度下,体系所处的状态,平衡共存的各相组成如何,各个相的量之间有什么关系,以及当外界条件发生变化时,相变化进行的方向和限度。因此,金属相图的绘制对于了解金属的成分、结构和性质之间的关系具有十分重要的意义。
本实验所绘制的二组分体系属于液相完全互溶,而固相完全不互溶的简单低共熔体系,它是二组分凝聚体系中最简单的一种,是研究其它类型相图的基础。值得注意的是,锡和铅在固相可以部分互溶,并非完全不互溶,属于固相部分互溶且具有低共熔点类型体系。
理想的步冷曲线应如图5-2中(a)所示,但实际测量时常常因出现过冷现象而使步冷曲线变形(如图5-2中(b)所示),即“平阶”变短,“拐点”更难确定。此时可利用直线外推法(图中虚线所示)近似求得“拐点”及“平阶”长度。
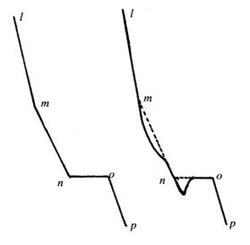
图 5-2 过冷现象对步冷曲线的影响及相变温度的确定
绘制相图的实验方法一般多采用各种物理化学方法,如目测法、热重量法、差热分析法等。此外,还可借助于金相显微镜、X射线衍射等其它实验技术。近年来由于实验技术的飞速发展,使得实验测得的相图越来越准确。在基础物理化学实验中,绘制固—液体系相图,仅介绍“溶解度法”和“热分析法”。“溶解度法”是在确定的温度下,直接测定固、液平衡两相的组成,多用于水—盐体系;而“热分析法”多用于合金体系,由于此方法不需要对平衡相作机械分离和化学分析,简单易行,因而得到了广泛的应用,希望同学们能够理解并掌握这种方法。
通过本实验的学习,有助于同学们理解为什么制备焊锡(锡和铅的混合物)时,组成选择在锡质量分数为 61.9%左右;为什么保险丝(铋、铅、锡、镉四种金属的合金)的熔点很低(只有70 ℃)以及为什么可以利用熔点来鉴定物质的纯度等一系列问题。
|