|
反应速率只与某反应物浓度成正比的反应称为一级反应,即速率方程为:
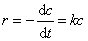
式中c是反应物t时刻的浓度,k是反应速率系数。积分上式得:
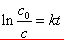 (推导) (推导)
式中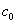 为t = 0时刻的反应物浓度。一级反应具有以下两个特点: 为t = 0时刻的反应物浓度。一级反应具有以下两个特点:
(1)以lnc对于t作图,得一直线,其斜率m = - k。
(2)反应物消耗一半所需的时间称为半衰期,以t1/2表示。将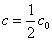 代入上式,得一级反应的半衰期为 代入上式,得一级反应的半衰期为 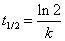 表明一级反应的半衰期t1/2只决定于反应速率常数k,而与反应物起始浓度 表明一级反应的半衰期t1/2只决定于反应速率常数k,而与反应物起始浓度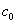 无关。 无关。
蔗糖在酸性溶液中的水解反应为
C12H22O11(蔗糖)+H2O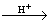 C6H12O6(葡萄糖)+ C6H12O6(果糖) C6H12O6(葡萄糖)+ C6H12O6(果糖)
实验表明,该反应的反应速率与蔗糖、水和氢离子三者的浓度均有关。在氢离子浓度不变的条件下,反应速率只与蔗糖浓度和水的浓度有关,但由于水是大量的,在反应过程中水的浓度可视为不变。在这个情况下,反应速率只与蔗糖浓度的一次方成正比,其动力学方程式符合r = kc式,所以此反应为准一级反应。
蔗糖及其水解产物都是旋光性物质。本实验就是利用反应体系在水解过程中旋光性质的变化来跟踪反应进程。蔗糖、葡萄糖和果糖的比旋光度分别为:蔗糖 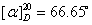 ,葡萄糖 ,葡萄糖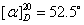 ,果糖为 ,果糖为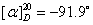 。正值表示右旋,负值表示左旋。 。正值表示右旋,负值表示左旋。
由于果糖的左旋性大于葡萄糖的右旋性,因此随着水解反应的进行,产物浓度的增加,反应体系的旋光度将由正值经零变为负值。以下导出蔗糖的浓度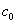 、c与反应体系旋光度之间的关系。 、c与反应体系旋光度之间的关系。
在其他条件不变的情况下,旋光度α与物质的浓度成正比。即 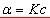 。(推导) 。(推导)
式中K =  。 。
因旋光度具有加和性,所以溶液的旋光度为各组分旋光度之和。设反应时刻为0、t和∞时,溶液旋光度分别为α0、αt和α∞,蔗糖,葡萄糖和果糖的K分别为K1,K2和K3,则
t = 0 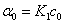
t = t 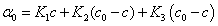
t = ∞ 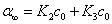
将前两式分别减去最后一式,得
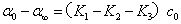
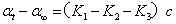
上两式相除,得
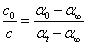
将此式代入一级反应的动力学方程式中,得
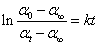
改写成
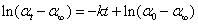
由上式可以看出,以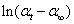 对t作图可得一直线,由直线的斜率(m = - k)即可求得反应速率系数k,由截距可得到α0。 对t作图可得一直线,由直线的斜率(m = - k)即可求得反应速率系数k,由截距可得到α0。
|