|
[实验关键提示]
1. 本实验原理成立的前提条件是在假设两种反应物浓度相等的条件下推导出来的,因此必须保证NaOH和CH3COOC2H5的初始浓度相等,为此在配制溶液时应注意:
先配制一个浓度较大的NaOH 溶液(如0.5 mol.dm-3左右),用邻苯二甲酸氢钾准确标定其浓度,所用蒸馏水(最好用电导水)事先煮沸以除去溶于水中的CO2,并用碱石灰吸收管保存溶液。实验前稀释成0.02 mol.dm-3即可。
配制CH3COOC2H5 溶液时,可在容量瓶中先加2/3体积的水,再用移液管吸取所需CH3COOC2H5 的体积,加水至刻度摇匀。CH3COOC2H5 的密度按下式计算:ρ/(g.dm-3) =0.92454-1.168×10-3(t/oC)-1.95×10-6(t/oC) 。另外,由于CH3COOC2H5在水中也会发生缓慢水解:
CH3COOC2H5 +H2O → CH3COOH+C2H5OH,
因此长期放置的溶液应废弃。
2. 温度的变化对反应速率及电导值本身均有较大影响,因此一定要保证恒温。
3. 待恒温后,两种反应液迅速混合均匀。因反应初期电导值变化较大,要确保计时的准确性。
4. 实验操作过程中不要触及电导电极的铂黑,以免使铂黑脱落而改变电导池系数。实验结束后,用蒸馏水冲洗电极,之后浸泡在蒸馏水中。
[讨论]
乙酸乙酯皂化反应动力学早在1887年由Stwald和rrhenius等人所确定,是最早经定量研究的二级反应。因反应体系适合于电导法进行连续测定,因而被选入基础物理化学实验教材,作为典型的动力学实验沿用至今。
反应体系适合于电导法测定是基于电导与浓度的正比关系以及电导具有加和性。根据电化学中的电导理论,电解质溶液的电导G与浓度c 有如下关系:
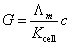
对1-1价型强电解质的稀溶液,Λm随浓度变化不大,因此可近似认为G与浓度c成线性关系,其实质是忽略了离子间的相互作用。本实验反应体系初始浓度选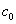 =0.01 mol·dm-3 ,就是既保证了这种线性关系,又能使电导值有较明显的变化。 =0.01 mol·dm-3 ,就是既保证了这种线性关系,又能使电导值有较明显的变化。
乙酸乙酯皂化反应为吸热反应,反应初期表现尤为严重,为防止其温度变化,在混合后并不立即记数,而是在混合后的第5分钟开始记数,否则将使Gt数值偏低,从而影响Gt对(G0-Gt)/t作图的线性。
可以将k= 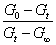 一式改写成多种不同形式的线性方程进行数据处理,如: 一式改写成多种不同形式的线性方程进行数据处理,如:
Gt=- k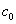 (Gt- G∞)t + G0 (Gt- G∞)t + G0
以Gt对(Gt- G∞)t 作图,可以得到一条直线,直线的斜率为- k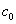
还可以改写成
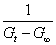 = = 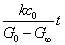 + +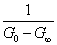
以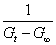 对t作图也可以得到一条直线,直线斜率为 对t作图也可以得到一条直线,直线斜率为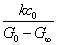 。同学们可以按上述方法进行数据处理,并加以分析比较。但以上两种计算方法均需要用到G∞,得到G∞除了用直线外推法外,还可以通过测定0.01 mol·dm-3 CH3COONa 溶液得到。根据古根亥姆(Guggenheim)法进行数据处理可不必求G0和G∞。 。同学们可以按上述方法进行数据处理,并加以分析比较。但以上两种计算方法均需要用到G∞,得到G∞除了用直线外推法外,还可以通过测定0.01 mol·dm-3 CH3COONa 溶液得到。根据古根亥姆(Guggenheim)法进行数据处理可不必求G0和G∞。
电导测定属电化学测量技术,是物理化学实验中最基本的测量方法之一。本实验也可以改用“实验8”的实验装置——惠斯登(Wheatstone)电桥测量电导,使测量精度提高,但测量过程时间比较长。
|