|
乙酸乙酯的皂化反应是一个典型的二级反应:
CH3COOC2H5+OH-→CH3COO-+C2H5OH
设反应物乙酸乙酯与碱的起始浓度相同,则反应速率方程为:
r =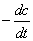 =kc2 =kc2
积分后可得反应速率系数表达式:
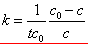 (推导) (推导)
式中: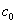 为反应物的起始浓度;c为反应进行中任一时刻反应物的浓度。为求得某温度下的k值,需知该温度下反应过程中任一时刻t的浓度c。测定这一浓度的方法很多,本实验采用电导法。 为反应物的起始浓度;c为反应进行中任一时刻反应物的浓度。为求得某温度下的k值,需知该温度下反应过程中任一时刻t的浓度c。测定这一浓度的方法很多,本实验采用电导法。
用电导法测定浓度的依据是:
(1) 溶液中乙酸乙酯和乙醇不具有明显的导电性,它们的浓度变化不致影响电导的数值。同时反应过程中Na+的浓度始终不变,它对溶液的电导有固定的贡献,而与电导的变化无关。因此参与导电且反应过程中浓度改变的离子只有OH-和CH3COO-。
(2) 由于OH-的导电能力比CH3COO-大得多,随着反应的进行,OH-逐渐减少而CH3COO-逐渐增加,因此溶液的电导随逐渐下降。
(3) 在稀溶液中,每种强电解质的电导与其浓度成正比,而且溶液的总电导等于溶液中各离子电导之和。
设反应体系在时间t=0,t=t 和t=∞时的电导可分别以G0、Gt 和G∞来表示。实质上G0是
NaOH溶液浓度为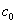 时的电导,Gt是 NaOH溶液浓度为c时的电导与CH3COONa溶液浓度为 时的电导,Gt是 NaOH溶液浓度为c时的电导与CH3COONa溶液浓度为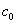 - c时的电导之和,而G∞则是产物CH3COONa溶液浓度为 - c时的电导之和,而G∞则是产物CH3COONa溶液浓度为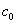 时的电导。即: 时的电导。即:
G0=K反c0
G∞=K产c0
Gt=K反c+K产(c0- c)
式中K反,K产是与温度,溶剂和电解质性质有关的比例系数。
处理上面三式,可得
G0- Gt=(K反- K产)(c0- c)
Gt- G∞=(K反- K产)c
以上两式相除,得 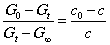
代入上面的反应速率系数表达式,得
k= 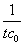 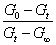
上式可改写为如下形式:
Gt= 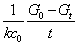 + G∞ + G∞
以Gt对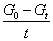 作图,可得一直线,直线的斜率为 作图,可得一直线,直线的斜率为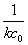 ,由此可求得反应速率系数k,由截距可求得G∞。 ,由此可求得反应速率系数k,由截距可求得G∞。
二级反应的半衰期t1/2 为:
t1/2=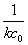
可见,二级反应的半衰期t1/2 与起始浓度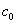 成反比。由上式可知,此处t1/2 即是上述作图所得直线之斜率。 成反比。由上式可知,此处t1/2 即是上述作图所得直线之斜率。
若由实验求得两个不同温度下的速率系数k,则可利用阿累尼乌斯(Arrhenius)公式:
ln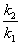 = =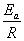 ( (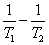 ) )
计算出反应的活化能Ea。
|