| 电解质溶液的导电能力由电导G来量度,它是电阻的倒数,即: 电导的单位是“西门子”,符号为“S”, 将电解质溶液放入两平行电极之间,若两电极距离为l,电极面积为A,则溶液的电导为: 式中 则 通常将一个电导率已知的电解质溶液注入电导池中,测其电导,根据上式即可求出Kcell。 在研究电解质溶液的导电能力时,经常使用摩尔电导率 式中c为电解质溶液的浓度, 对于弱电解质(例如醋酸)来说,由于其电导率很小,所以测得的溶液的电导率应包括水的电导率,即 电解质溶液是由正、负离子的迁移来传递电流的,在弱电解质溶液中,只有解离部分的离子才对电导有贡献,而在无限稀释的溶液中,电解质全部解离,其摩尔电导率 式中ν+,ν-分别为正、负离子的化学计量数, 式中α为弱电解质的解离度。 醋酸在水溶液中有下列平衡: 其解离平衡常数为 将 此式称为奥斯特瓦尔德(Ostwald)稀释定律。改写成线性方程为: 以 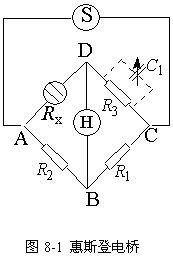 整理可得: 电解质溶液的电导通常利用惠斯登(Wheatston)电桥测量,但测量时不能用直流电源,因直流电流通过溶液时,导致电化学反应发生,不但使电极附近溶液的浓度改变引起浓差极化,还会改变两极的本质。因此必须采用较高频率的交流电,其频率通常选为1000Hz。另外,构成电导池的两极采用惰性铂电极,以免电极与溶液间发生化学反应。 惠斯登电桥的线路如图8-1所示,其中S为交流信号发生器, R1、R2和R3是三个可变交流变阻箱的阻值,Rx为待测溶液的阻值,H为耳机(或示波器),C1为在R3上并联的可变电容器,以实现容抗平衡。测定时,调节R1、R2、R3和C1,使H中无电流通过,此时电桥达到了平衡。则有: Rx的倒数即为溶液的电导,即 由于温度对溶液的电导有影响,因此实验应在恒温条件下进行。 本实验通过测定0.02mol 根据 |