|
【实验关键提示】
1.电池电动势的数值直接与电极的表面状态有关。初次制备锌电极时,务必除去表面的氧化层,经硝酸亚汞溶液处理后,即在锌电极的表面形成了一层均匀的汞齐。同样铜电极经酸洗除去氧化层,电镀后也形成了一层致密均匀的铜镀层,从而提高了电极电势数值的重复性。电镀时,如果无法估计电流密度的大小,将电流强度调至25mA即可。
2.电极管装液前,需要用少量的电解质溶液淋洗,以确保浓度的准确性,装液后要检查是否漏液和电路是否畅通,特别是电极的虹吸管内不能有气泡。实验结束后,应将电极管内溶液倒掉,以防止对电极腐蚀。
3.本实验使用市售的饱和甘汞电极,使用时要将上下两个橡皮塞取下,取下上面的橡皮塞是为了保持电极内外的压力平衡,防止溶液倒流入甘汞电极中。另外,甘汞电极和盐桥中应保留少量氯化钾晶体,使溶液处于饱和状态。
4.要确保电池在平衡状态下测量。当测完一个数据后,隔数分钟再重复测定两次,若偏差小于0.5 mV,则可认为已达平衡,取其平均值作为该电池的电动势。
【讨论】
研究可逆电池的电动势具有十分重要的意义,它不仅揭示了化学能转化为电能的最高限度,从而为改善电池性能提供依据,更重要的是在研究可逆电池电动势的同时,也为解决化学热力学问题提供了电化学的方法和手段。由于电动势能够精确测量(精度可达几毫伏),所以由电化学方法测得的热力学函数(如ΔrHm、ΔrGm、ΔrSm等)往往比量热法得到的要精确一些。当然,电化学方法也有其局限性,因为并非所有的化学反应都能够设计成电池。
电动势的测量属于平衡测量,本实验从电极制备到测量过程,都是在尽可能遵循可逆条件来设计实验的,例如,铜电极需要电镀,锌电极需要制成汞齐。因为汞齐电极具有快速平衡,完全可逆和受杂质影响较纯金属小的优点。对于一些活泼的金属(如Na、K等),常制成汞齐才能在水溶液中形成稳定的电极。与其它汞齐不同的是,锌在汞齐中处于饱和状态(活度为1),因此锌汞齐的电极电势与锌电极的电极电势相同。其次为了使测量过程符合可逆条件的要求,采用了对消法。近年来,由于实验技术的发展,使测量过程更加自动化,目前在实验室中可以采用电子电位差计,晶体管毫伏计和数字电压表等进行电动势测量,由于它的输入阻抗极高,几乎是在没有电流通过的情况下测量的,因而其效果与传统的电位差计十分相似。
本实验测定的是室温下电池的电动势,电动势的温度系数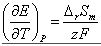 (推导) ,对于凝聚体系反应,ΔrSm较小,当温度变化范围较小时,可以忽略,精密测量时应置于恒温槽中进行。 (推导) ,对于凝聚体系反应,ΔrSm较小,当温度变化范围较小时,可以忽略,精密测量时应置于恒温槽中进行。
电化学体系中含有电解质溶液,决定了电化学测量方法的特殊性。如测量电导的惠斯登电桥法、测量电池电动势的对消法以及测定极化电极超电势的三电极法等,这些都是电化学实验中最基本的实验方法。其中电池电动势的测定有着十分广泛的应用,如测定溶液的pH、活度因子、计算平衡常数以及电势滴定等,希望同学们结合物理化学理论课的学习,能够理解和掌握这些应用,从中学会将一些化学问题转变为电化学问题进行研究的理论和实验方法。
查25oC标准电极电势数据得,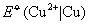 =0.337V; =0.337V;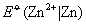 =-0.7628V。同学们可将实验结果与此比较,两者相差不应大于2mV。 =-0.7628V。同学们可将实验结果与此比较,两者相差不应大于2mV。
|