|
热化学测量技术
一、量热技术
2、测量原理
从上述量热计的构造中我们了解到,量热计的内筒,包括其内的水、氧弹及搅拌棒等近似构成了一个绝热体系。通过贝克曼温度计测量出燃烧反应前后的温度改变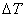 ,若已知量热计的热容C(升高单位温度时所吸热的热量),则总共产生的热量即为C ,若已知量热计的热容C(升高单位温度时所吸热的热量),则总共产生的热量即为C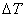 。 。
根据能量守恒原理可知,此热量的来源应包括样品燃烧放热和点火丝放热两部分:
C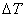 =样品燃烧放热+点火丝燃烧放热 =样品燃烧放热+点火丝燃烧放热
即C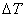 = mQV+m点火丝Q点火丝 = mQV+m点火丝Q点火丝
式中m为待测物质的质量,QV为待测物质的恒容热,Q点火丝为点火丝的恒容热)对于镍铬合金丝,其Q点火丝=3240J·g-1);m点火丝为点火丝的质量;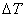 为样品燃烧前后量热计温度的变化值,通常用已知QV的物质标定量热计热容量C,一般采用高纯度的苯甲酸作为标准物质(其恒容热QV=26460J·g-1)。当求出量热计热容量C之后,就可以利用上式通过实验测定其它物质的恒容热。 为样品燃烧前后量热计温度的变化值,通常用已知QV的物质标定量热计热容量C,一般采用高纯度的苯甲酸作为标准物质(其恒容热QV=26460J·g-1)。当求出量热计热容量C之后,就可以利用上式通过实验测定其它物质的恒容热。
┆返回→【热化学测量技术】┆
|