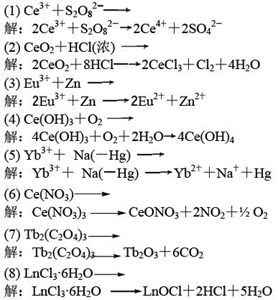第八章课后习题参考答案
5.镧系配合物有什么特点 ?列举几个实例加以说明:
解:镧系配合物与过渡配合物差别比较大,与碱土配合物更加接近。
(1) 镧系元素的配位性能
镧系元素离子的外层电子是稀有气体型的原子结构,与碱土离子相同,它的4f电子被s2和5p6外层电子所屏蔽,一般不易参加成键,而且f轨道的配位场稳定化能很小,所以镧系配合物主要表现为离子型键,只靠静电作用用结合到一起。这就使得镧系离子的配位性能和d区过渡元素离子的差别较大。但是,由于镧系离子具有较高的正电荷,因而他们的配位能力又比Ca2+、Ba2+稍大,而与同价过渡离子相比,镧系离子半径较大,离子势较小,碱性较大,所以对配位基团的静电引力较小,配位键的强度较弱,而过渡金属离子既有较强烈的共价作用,也有较强烈的静电作用。
镧系离子半径大,离子势小,极化能力小,镧系离子与配位原子主要以静电引力相结合,故配位键主要是离子键型的。但对那些强螯合剂(如EDTA)中的胺基氮原子、酸性膦型萃取剂中磷酰基上的氧原子配位时,配位场作用强,引起4f轨道电子离域,使配合物表现出部分共价键的性质。
由于镧系离子与配位基团的作用力,所以配位基团的活动性较大,交换反应速率快,以至有的配合物虽然可以制备得到固体,但在溶液中却是不存在的(镧系离子与配体的反应快,易发生配体取代反应)。相反,有的配合物仅能在溶液中检测到他们的存在,却无法使他们从溶液中析出。与此相比较,过渡元素的配合物一般比较稳定,也就易于制备获得。
(2) 配位原子
具有稀有气体构型的镧系离子是属于硬酸的离子,一般和硬碱如O2-、F- 等配合较稳定。因此,在水溶液中由于水分子的竞争能力强,使得一些配位能力较弱的原子(如N、S等)不能取代镧系水合离子中的水分子。与之相比,过渡离子属于软酸离子、一般和软
碱离子如 S2-、N3-等配合较为稳定。因此,过渡配合物比镧系配合物的种类要多得多,对一些镧系离子的N和S的配合物,只能在非水溶剂或无溶剂条件下制备。
配体的电负性越大,配位能力就越强,因而氟、氧有最强的配位能力, 氮原子次之,硫(硒、碲)、磷的配位能力较弱,单齿配体的配位能力有这样的顺序:
F>OH->H2O>NO3->Cl-
(3) 配位数
镧系元素与过渡金属的最大区别是镧系离子能生成高配位数的配合物。过渡金属离子的最常见配位数是4和6,而镧系离子最常见的配位数是8和9。镧系离子在形成配位键时,键的方向性不强,空间因素对配位数起着主要作用,在配体与金属离子相对大小许可的条件下,配位数可在3~12范围内变动。
镧系配合物的配位数与离子半径和配体的性质有关,一般随镧系离子半径的减小,配位数有降低的倾向,例如半径较小的Yb3+离子形成七配位配合物[Yb(acac)3(H2O)],而半径较大的La3+离子则形成11配位的配合物[La(acac)3(H2O)5]。配体的体积和电荷对配位数也有影响。配体体积增大会使配位数变小;配体电荷增大时,金属的配位数有降低的倾向。
下面列出配位数为6、7、8、9的镧系元素配合物实例及其几何构型:
配位数 实例 几何构型
6 Er(NCS)63- 八面体
7 Ho(dpm)3·H2O 单帽八面体
Yb(acac)3·H2O 单帽三棱柱体
NdF73- 五角双锥体
8 Eu(dpm)3(py)2 四方反棱柱体
RE(HOCH2COO)3·2H2O 十二面体
9 Nd(H2O)93+ 三帽三棱柱体
Er(C2O4)2(HC2O4)·3H2O
单帽四方棱柱体
6.完成并配平下列反应方程式:
(1)Ce3++S2O82-→ (2)CeO2+HCl(浓)→ (3)Eu3++Zn→ (4)Ce(OH)3+O2→
(5)Yb3++Na(-Hg)→ (6)Ce(NO3)→ (7)Tb2(C2O4)3→ (8)LnCl3·6H2O→
解: