第八章课后习题参考答案
7.写出Sm3+离子的基态光谱项,计算它的磁矩。
解: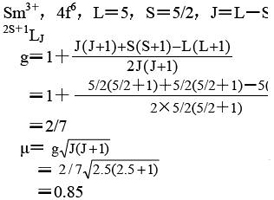
8.简述镧系离子磁性变化的规律性。
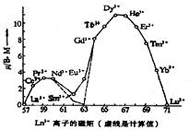
解:右图示出镧系离子磁性变化的规律性。图中显示的的双峰形状是由于镧系离子的总角动量呈现周期性变化所致。除Sm3+和Eu3+外,其他离子的计算值和实验值都很一致,Sm3+和Eu3+的不一致被认为是在测定时包含了较低激发态的贡献。
9.指出铀的:
①最稳定的氧化态;
②适合作核燃料的同位素;
③常见的U(Ⅵ)的卤化物;
④实验室中最常见的铀盐;
⑤环辛四烯基化合物。
解:①+6
②235U
③UF6
④UO2(NO3)2
⑤(C8H8)2U,用以下方法制备:
10.写出下列化合物的制备方法
(1) ThO2; (2) UO2; (3) UF6; (4) UO2(NO3)2·6H2O
解:(1) ThO2用浓碱液处理独居石,将得到的镧系和钍的氢氧化物溶于酸后,用磷酸三丁酯进行萃取分离,从溶液中析出的ThO2。或在500K使Th与O2作用均可制得ThO2。
(2) UO2沥青矿中铀的主要成份U3O8,用浓碱液处理后用沉淀法、溶剂萃取法或离子交换法可得到硝酸铀酰(UO2(NO3)2(H2O)4),再用CO还原可得到UO2。
(3) UF6、 UO2再溶于HF形成UF4,UF4与F2作用可得 UF6。
(4) UO2(NO3)2·6H2O用浓碱液处理沥青矿,然后用沉淀法、溶剂萃取法或离子交换法可得到硝酸铀酰。
11.试解释下列现象:
(1)锕系元素形成配合物的倾向比镧系强。
(2)锕系离子实测磁矩比计算值低。
(3)镧系中有Sm2+和Eu2+存在,但锕系中无Pu2+和Am2+。
(4) 从Ac到Am有AnO22+和AnO2+含氧阳离子但Am后重元素却不存在。
解:(1)锕系元素的 5f 轨道在空间伸展的范围超过了6s和6p轨道,一般认为可以参与共价成键,这与镧系元素不同,在镧系元素中,4f轨道因受5s25p6
的屏蔽不参与形成共价键,与配体主要是用静电引力结合。所以锕系元素形成配合物的能力远大于镧系元素,与 X-、NO3-、SO42-、PO43-、C2O42-等都能形成配合物。
(2)锕系元素的顺磁性其实验值比计算值低,这可能是由于5f电子受配位体一定程度的影响所造成的,因为配位场在一定的程度上可以消灭或削弱轨道对磁矩的贡献。
(3)Sm2+ 4f6;Eu2+ 4f7;Pu2+
5f6;Am2+ 5f7。尽管从形式上看,镧系的Sm2+和Eu2+和锕系的Pu2+和Am2+差不多,都是nf6、nf7的电子组态,但总体上说,锕系前一部分元素从5f→6d的激发能较小,5f电子容易参与成键,因而元素可以表现出高氧化态,所以它们的低氧化态是不稳定的从而不存在。
(4)因为锕系前一部分元素从5f→6d的激发能较小, 5f电子容易参与成键,因而元素可以表现出高氧化态。锕系前面一部分元素(Th→Bk)容易出现大于+3
的高氧化态。这是因为锕系前一部分元素从5f→6d的激发能较小,5f电子容易参与成键,因而元素可以表现出高氧化态。后一半从5f→6d的激发能较大,5f电子参与成键变得越来越困难,所以氧化态又逐渐降低,且+3
氧化态逐渐趋于稳定。而高氧化态离子极化能力强,倾向于与O2+离子结合成含氧阳离子,而低氧化态离子极化能力弱,以独立离子形式存在。