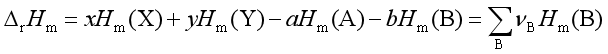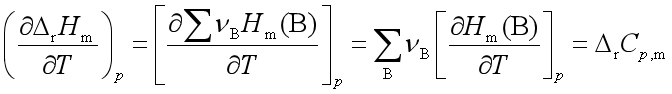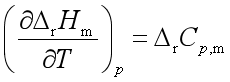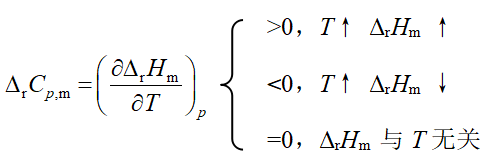当前位置:课程学习>>第一章 热力学第一定律>>知识讲解>>视频课堂>>知识点八
知识点八:化学反应焓变的计算
一、反应焓的估算
1、键解离焓与键焓
一切化学反应实际上都是原子或原子团的重新排列组合,反应过程就是旧键断裂和新键形成的过程。由于旧键断裂和新键形成都有能量的变化,所以从本质上说就是出现反应焓的原因。如果我们知道分子中各原子间的键能,就可以根据反应过程中化学键的变化情况计算反应焓,这是从物质结构的角度解决反应焓的根本途径。但到目前为止,有关键能的数据尚不完善,只能作近似的计算。
键解离焓:断裂气态化合物中某一具体的键生成气态原子或原子团所需的能量。例如:
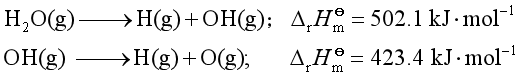
键焓则是键解离焓平均值:
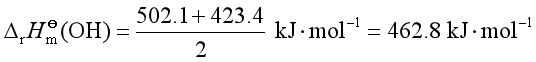
键焓的求法:光谱数据和量热法。
一些键焓数据:D/(kJ·mol-1)
H-H 436 C-H 414 O-H 463
O-O 139 O=O 498 C-C 344
H-H 436 C=C 610 N-H 390
2、由键焓估算反应焓
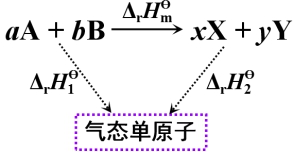
![]()
即反应焓变![]() 等于反应物键焓的总和减去生成物键焓的总和。。
等于反应物键焓的总和减去生成物键焓的总和。。
二、反应焓与温度的关系
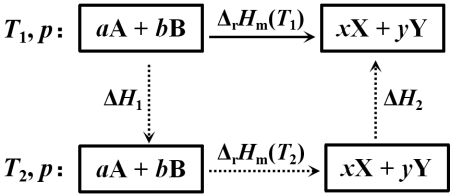
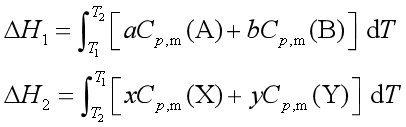
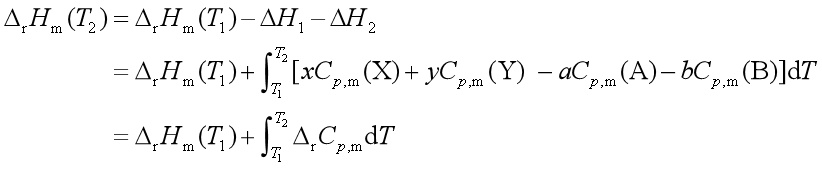
式中:
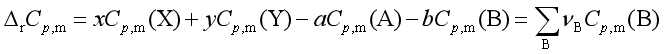
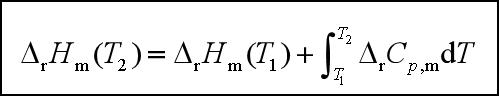
此式是基尔霍夫公式的积分式,它是热力学第一定律的推演,利用该式可以从某一温度下的反应焓计算另一温度的反应焓。计算时注意:![]() ,若反应物质存在相变,则应分段计算
,若反应物质存在相变,则应分段计算![]() 或
或![]() ,且考虑相变焓。
,且考虑相变焓。
若 ![]() ,则
,则
![]()
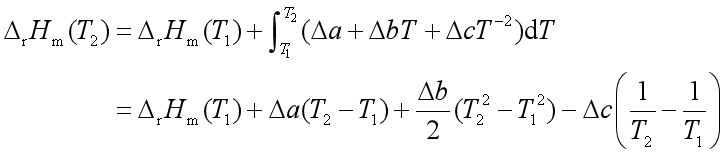
通常取![]() ,
, ![]() 从手册上提供的数据计算得到。
从手册上提供的数据计算得到。
基尔霍夫定律的微分式:
![]()