第二章 热力学第二定律
 知识点七:ΔG的计算
知识点七:ΔG的计算
一、单纯的pVT状态变化
系统发生简单状态变化时,若温度不变,则V和p都将改变,所以可根据基本公式之一式(40),或由对应系数关系式式(44)均可得
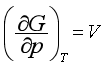
则 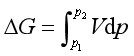
若知道V与p的函数关系,就能对上式积分求得ΔG。对于理想气体,可得
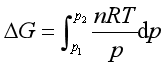
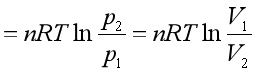 (52)
(52)
对于凝聚系统,压力对体积影响不大,体积可视为常量,所以
ΔG=V(p2-p1)(53)
等温的状态变化ΔG的计算,也可由G的定义式出发,因G=H-TS,则
ΔG=ΔH-Δ(TS)=![]()
等温条件下
ΔG=ΔH-TΔS
由ΔH和ΔS求得ΔG。例如理想气体,等温下ΔH=0,所以
ΔG=-TΔS=-QR=WR
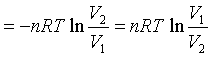
其结果与式(52)完全相同。
例7 300.2K时,1mol理想气体从10![]() 等温可逆膨胀到
等温可逆膨胀到![]() ,求Q、W、ΔU、ΔH、ΔS、ΔA和ΔG。若由真空膨胀来完成同一变化,结果又将如何?
,求Q、W、ΔU、ΔH、ΔS、ΔA和ΔG。若由真空膨胀来完成同一变化,结果又将如何?
解 等温可逆膨胀
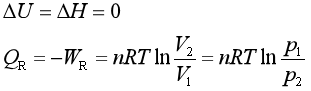
=[8.314×300.2ln(10/1)] J =5747J
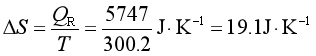
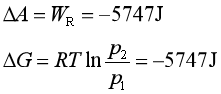
或由A和G的定义式可得,等温条件下
△A=△G=-T△S=-QR=WR=-5747J
若由真空膨胀完成同一变化,则W=0,Q=0。所有热力学函数的变化值只与系统的始、终态有关,因此它们的数值完全与可逆膨胀的结果相同。
二、相变化
1.可逆相变
可逆相变即是在相平衡温度、压力下进行的相变,此过程只作体积功。根据吉布斯自由能判据,等温等压、W′=0的可逆过程,ΔG=0。所以对于可逆相变,不必进行计算即可判定其ΔG=0。
例8 在373.2K和![]() 时,把1mol的水蒸气可逆压缩为液态水,计算Q、W、ΔU、ΔH、ΔS、ΔA和ΔG。已知该条件下水的蒸发热为40.69kJ
时,把1mol的水蒸气可逆压缩为液态水,计算Q、W、ΔU、ΔH、ΔS、ΔA和ΔG。已知该条件下水的蒸发热为40.69kJ![]() mol-1。
mol-1。
解 WR=-peΔV=-p(Vl-Vg)≈pVg=RT
=8.314×373.2 J![]() mol-1=3103J
mol-1=3103J![]() mol-1
mol-1
QR=Qp=ΔvapHm=-40.69×103J![]() mol-1
mol-1
ΔU=Q+W=(-40.69×103+3.103×103)J![]() mol-1=-37.59×103J
mol-1=-37.59×103J![]() mol-1
mol-1
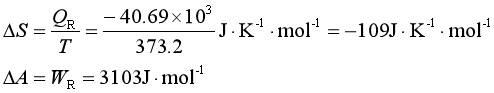
![]() (因为是等温等压可逆相变)
(因为是等温等压可逆相变)
2.不可逆相变
不可逆相变即是在非相平衡温度、压力下进行的W′=0的不可逆相变,该条件下的不可逆过程不可能通过相同条件的可逆过程来完成,与计算不可逆相变![]() 类似,也需设计一系列其他条件下的可逆过程完成此变化,其原则是不改变过程的温度(或压力),并由所设计的可逆过程来求得该变化的ΔG值。
类似,也需设计一系列其他条件下的可逆过程完成此变化,其原则是不改变过程的温度(或压力),并由所设计的可逆过程来求得该变化的ΔG值。
例9 水在298.2K,![]() 下进行的相变:
下进行的相变:
H2O(l,298.2K,![]() )→H2O(g,298.2K,
)→H2O(g,298.2K,![]() )
)
计算该相变的ΔG,并判断变化能否自动进行。已知H2O(l)在25℃时的饱和蒸气压为0.0313![]() 。
。
解 :这是不可逆相变过程,需设计过程求ΔG。在保持温度不变的条件下,将该相变与298.2K的可逆相变相联系,设计如下的可逆过程:
.png)
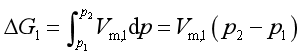 (因水的可压缩性甚微,V可作为常数)
(因水的可压缩性甚微,V可作为常数)
![]() (等温等压可逆相变)
(等温等压可逆相变)
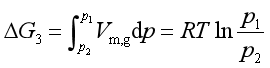
所以 ΔG=ΔG1+ΔG2+ΔG3
=Vm,l(p2-p1)+RTlnp1/p2
=[18.02×10-6×(0.0313-1)×105+8.314×298.2ln0.0313] J![]() mol-1
mol-1
=(-1.746+8591.3) J![]() mol-1=8590J
mol-1=8590J![]() mol-1
mol-1
等温等压下ΔG>0,说明变化不能自动进行。
通过以上计算可以看出,凝聚相(液相或固相)等温变压过程的ΔG1要比气相同类过程的ΔG3小得多,常常可以忽略不计。
三、化学变化
等温等压的化学反应
aA+bB![]() yY+zZ
yY+zZ
除非反应已达平衡(ΔrGm=0),则不论反应自发或非自发,过程均不可逆,因此需要设计可逆过程来计算反应的ΔrGm。
最简单的方法是将反应安排成可逆电池进行放电(自发反应)或充电(非自发反应),则
ΔrGm=-zEF
但并非所有的反应都能安排成可逆电池,所以该方法不具有普遍性。
如果化学反应的ΔrHm和ΔrSm为已知时,便不必设计可逆过程,可直接由ΔrHm和ΔrSm计算ΔrGm,即
ΔrGm=ΔrHm-TΔrSm
化学反应的ΔrGm还有其他计算方法,如利用化学反应等温方程或利用物质的标准摩尔生成自由能![]() 等方法求ΔrGm。这些内容将在化学平衡一章中作详细论述。
等方法求ΔrGm。这些内容将在化学平衡一章中作详细论述。
例10 在298.2K和![]() 下,进行一化学反应,产生1mol气体,放热40.00×103J。若通过可逆电池来完成反应,则吸热4.00×103J。试计算反应的ΔrHm、ΔrSm、ΔrAm和ΔrGm。
下,进行一化学反应,产生1mol气体,放热40.00×103J。若通过可逆电池来完成反应,则吸热4.00×103J。试计算反应的ΔrHm、ΔrSm、ΔrAm和ΔrGm。
解 反应在等温等压下不可逆进行时,
Qp=ΔrHm=-40.00×103J
![]() =-peΔrVm≈-pVg=-nRT
=-peΔrVm≈-pVg=-nRT
=(-1×8.314×298.2)J=-2.48×103J
则
ΔrUm=Qp+![]() =(-40.00×103-2.48×103)J=-42.48×103J
=(-40.00×103-2.48×103)J=-42.48×103J
反应在可逆电池中进行时:
QR=4.00×103J
由可逆热QR可求得ΔrSm:
ΔrSm=QR/T=(4000÷298.2)J![]() K-1=13.41J
K-1=13.41J![]() K-1
K-1
ΔrAm=ΔrUm-TΔrSm=(-42.48×103-4.00×103)J=-46.48×103J
ΔrGm=ΔrHm-TΔrSm=(-40.00×103-4.00×103)J=-44.00×103J
ΔrAm和ΔrGm也可以由最大功求得
ΔrAm=WR=![]() +WR′
+WR′
而由ΔrUm=QR+WR=QR+WR′+![]() 与ΔrUm=Qp+
与ΔrUm=Qp+![]() 可得
可得
WR′=Qp-QR
所以
ΔrAm=![]() +Qp-QR
+Qp-QR
=(-2.48×103-40.00×103-4.00×103)J
=-46.48×103J
ΔrGm=WR′=-44.00×103J
四、ΔG与温度的关系
在研究化学反应问题时,常需由某一反应温度(T1)下的ΔG(T1)求得另一反应温度(T2)下的ΔG(T2),二者之间的关系讨论如下。
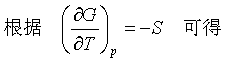
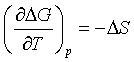
在温度T时,有
ΔG=ΔH-TΔS 或 -ΔS=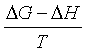
代入上式,得
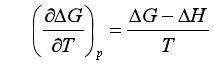 (54)
(54)
此式左边表示一个等温等压化学反应的ΔG在保持压力不变时对温度的变化率。将式(54)两边同除以T,并整理后可得
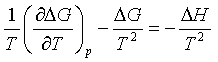
上式左方是压力不变时,(ΔG/T)对T的偏微商,即
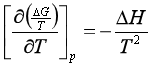 (55)
(55)
对上式作不定积分,得
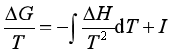 (56)
(56)
式中I是积分常数。
若对式(55)进行定积分,则有
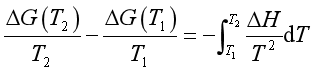 (57)
(57)
以上三式称为吉布斯—亥姆霍兹(Gibbs-Helmholtz)方程式。若已知ΔH及某温度(T1)下的ΔG(T1),便可应用本方程的积分形式(56)或(57)求得另一温度(T2)下的ΔG(T2)。
根据式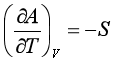 ,同样可以证明
,同样可以证明
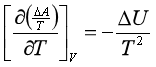 (58)
(58)
该式也称为吉布斯——亥姆霍兹方程式。等式左方是体积不变时,(ΔA/T)对T的偏微商。与式(2.57)类似的推导,可由系统T1温度下的ΔA(T1)计算另一温度T2下的ΔA(T2)。
例11 氨的合成
![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g)
H2(g)=NH3(g)
已知当各种气体的温度为298.2K和分压均为![]() 时,
时,
![]() =-46.19kJ·mol-1,
=-46.19kJ·mol-1,![]() =-16.63kJ•mol-1。求1000K时的
=-16.63kJ•mol-1。求1000K时的![]()
解:因![]() 与温度有关,故应先求得
与温度有关,故应先求得![]() 对T的函数表达式,查表得各物质的Cp,m,可得:
对T的函数表达式,查表得各物质的Cp,m,可得:
△rCp=(-25.46+18.33×10-3T/K-2.05×105T-2K2) J![]() K-1
K-1![]() mol-1
mol-1
所以![]() =∫△rCpdT+△H0(△H0为积分常数)
=∫△rCpdT+△H0(△H0为积分常数)
=△H0- (25.46T/K+![]() ×18.33×10-3T2/K2-2.05×105T-1K) J
×18.33×10-3T2/K2-2.05×105T-1K) J![]() mol-1
mol-1
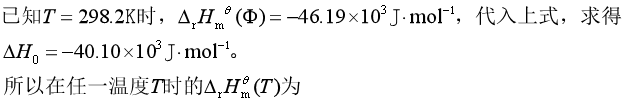
![]()
将![]() 代入吉布斯—亥姆霍兹方程式的不定积分式(2.56),得
代入吉布斯—亥姆霍兹方程式的不定积分式(2.56),得
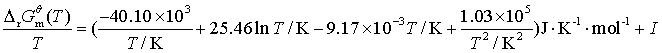
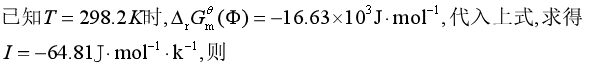
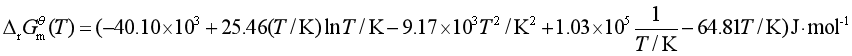
![]()
计算结果说明,在所给定的条件下,298.2K时合成氨的反应是自发的,有可能实现。但在1000K时,反应不能自动进行。
五、ΔG与压力的关系
一个等温等压下的化学变化或相变化,在保持温度不变的前提下,其ΔG将随压力的改变而改变。
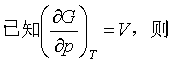
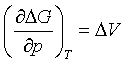
作定积分,得
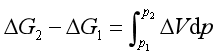
ΔG1和ΔG2分别是系统在同一温度,在两个不同压力下按等温等压进行时吉布斯自由能的变化。
例12 298K和![]() 下,相变
下,相变
C(石墨)→C(金刚石)
![]() =2862J·mol-1。已知石墨与金刚石的密度分别为2260 kg·m-3和3515kg·m-3。问需加压力至多大才能使变化成为自发?
=2862J·mol-1。已知石墨与金刚石的密度分别为2260 kg·m-3和3515kg·m-3。问需加压力至多大才能使变化成为自发?
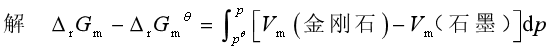
若密度与压力无关,则Vm可视为常量,便有
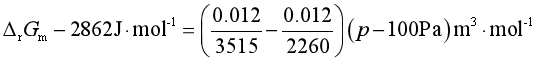
![]()
![]()
要使该相变化在等温等压下成为自发,则必须ΔrGm<0,即
2862 J·mol-1-1.896×10-6(p-100Pa)m3<0
解得 p>1.51×106Pa
压力必须大于1.51×106Pa才有可能使变化在298.2K,即室温时成为自发变化。
