一、基本内容
前面讨论的系统一般为纯组分或组成不变的均相封闭系统,只需要两个物理量,如温度和压力,就能确定系统的热力学性质。而对组成可变的多组分均相系统(如均相化学反应)或多组分多相系统(如二元液态混合物与其气相或固相的平衡),系统的热力学容量性质除与温度和压力有关外,还与系统的组成或物质的量有关。为此,在讨论多组分系统的热力学、相平衡和化学平衡之前,首先要掌握偏摩尔量、化学势的概念以及由此而引出的一系列定律和公式。
(一) 偏摩尔量
1. 定义
系统中任一组分B的偏摩尔量ZB被定义为
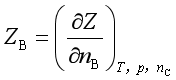
其物理意义是等温等压及除B组分外,其余各组分的量均保持不变的情况下,在无限大量系统中,加入1mol B组分所引起系统某热力学容量性质Z(V、U、H、S、A、G)的改变。
由此可见,ZB是温度、压力、各组分的物质的量的函数,即
式中C表示系统的组成。
2. 偏摩尔量的集合公式
等温、等压、定浓下,系统的热力学容量性质Z与各组分的偏摩尔量ZB之间有加和关系,称为偏摩尔量的集合公式。即
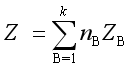
(二) 化学势
1. 定义
任何均相多组分系统的热力学容量性质均可表示为其特征变量与其组成的函数,因此


用热力学的四个基本方程可以证明
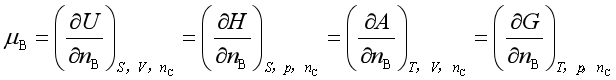
由定义式可知组分B的化学势就是此组分的偏摩尔吉布斯自由能。通常情况下,若不加以说明,化学势即指偏摩尔吉布斯自由能。
2. 化学势判据
等温、等压下过程进行的方向和限度可使用化学势判据,即 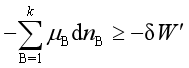 ,式中等号“=”用于可逆过程,“>”用于不可逆过程。
,式中等号“=”用于可逆过程,“>”用于不可逆过程。
若系统不作非体积功,即![]() ,则上述判据化为
,则上述判据化为 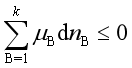 ,式中等号“=”用于可逆过程,“<”用于不可逆过程。
,式中等号“=”用于可逆过程,“<”用于不可逆过程。
3. 化学势与温度的关系
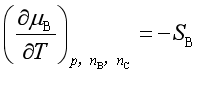
4. 化学势与压力的关系
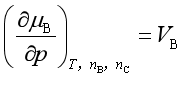
(三)多组成均相系统的热力学基本方程
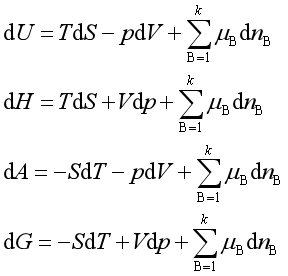
(四)理想气体化学势的表达式
1.纯理想气体化学势
处于某温度下的纯理想气体,选同温度下压力为100kPa的状态为其标准态,并以![]() 表示该标准态时的化学势。纯理想气体在温度为T,压力为p时化学势
表示该标准态时的化学势。纯理想气体在温度为T,压力为p时化学势![]() 的表达式为
的表达式为
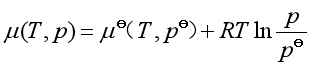
式中![]() 指的是温度为
指的是温度为![]() ,压力为
,压力为![]() 时纯理想气体的化学势,即理想气体标准态的化学势。因为它只与温度有关,故习惯上记作
时纯理想气体的化学势,即理想气体标准态的化学势。因为它只与温度有关,故习惯上记作![]() 。所以纯理想气体在温度为
。所以纯理想气体在温度为![]() 时化学势的表达式为
时化学势的表达式为
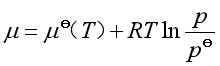
2. 混合理想气体中某组分 B的化学势
由于理想气体分子之间没有作用力,因此同温度下,混合理想气体中某组分B在其分压为![]() 时,它的行为与B气体单独存在,压力为
时,它的行为与B气体单独存在,压力为![]() 时的行为一样。故混合理想气体中分压为
时的行为一样。故混合理想气体中分压为![]() 的任一组分B的化学势可以用同温度下压力为
的任一组分B的化学势可以用同温度下压力为![]() 的纯B气体的化学势表示,即
的纯B气体的化学势表示,即
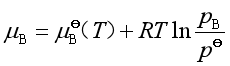
(五)实际气体的化学势
1. 纯实际气体的化学势
实际气体的状态方程不服从pV=nRT ,因此其化学势与压力的关系也不具有理想气体的![]() 与p 那样简单的关系。为了让各种实际气体的化学势的关系式与理想气体化学势表达式一致,引入逸度f ,把实际气体对理想气体的偏差归结于对压力的校正。故纯实际气体化学势表达式是
与p 那样简单的关系。为了让各种实际气体的化学势的关系式与理想气体化学势表达式一致,引入逸度f ,把实际气体对理想气体的偏差归结于对压力的校正。故纯实际气体化学势表达式是
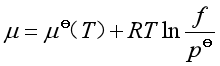
式中![]() 称为逸度, 定义
称为逸度, 定义![]() ,
,![]() 称为逸度因子。
称为逸度因子。
由此可见,实际气体与理想气体的偏差程度是由![]() 偏离1的多少来表示的。当
偏离1的多少来表示的。当![]() 时,
时,![]() ,
, ![]() 是实际气体在标准态时的化学势。选温度为
是实际气体在标准态时的化学势。选温度为![]() 时,
时,![]() ,且
,且![]() 的状态作为实际气体的标准态,这样一个标准态是个假想态——假想在压力为100 kPa时,实际气体遵从理想气体的状态方程。
的状态作为实际气体的标准态,这样一个标准态是个假想态——假想在压力为100 kPa时,实际气体遵从理想气体的状态方程。
对逸度的叙述用数学式表示
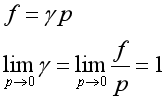
2. 实际气体混合物中B组分的化学势
实际气体混合物中任一组分B的化学势可用下式表达
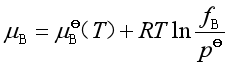
式中![]() 是B组分的逸度,它可由路易斯-兰德尔规则计算
是B组分的逸度,它可由路易斯-兰德尔规则计算
式中![]() 是同温时,纯B组分与混合气体总压相等时B的逸度;
是同温时,纯B组分与混合气体总压相等时B的逸度; ![]() 是混合气体中B组分的摩尔分数。应用路易斯-兰德尔规则的前提是假设气体在混合过程中体积具有加和性,故这不是个普遍规则,常作近似计算。
是混合气体中B组分的摩尔分数。应用路易斯-兰德尔规则的前提是假设气体在混合过程中体积具有加和性,故这不是个普遍规则,常作近似计算。
(六)稀溶液的两个经验定律
1. 拉乌尔定律
式中![]() 是溶液中溶剂的饱和蒸气压;
是溶液中溶剂的饱和蒸气压;![]() 是同温度下纯溶剂A的饱和蒸气压;
是同温度下纯溶剂A的饱和蒸气压;![]() 是溶液中溶剂的摩尔分数。
是溶液中溶剂的摩尔分数。
若溶剂在构成溶液时发生缔合,缔合度不大时,溶剂的相对分子质量仍按气态的相对分子质量计算。
2. 亨利定律
构成稀溶液的溶质具有挥发性,则当气液平衡时,气相中溶质的平衡分压![]() 为
为
式中 ![]() 是溶质组分的分压,
是溶质组分的分压,![]() 是溶质在溶液中的摩尔分数,
是溶质在溶液中的摩尔分数,![]() 称为亨利系数。它表示溶质的气化能力,所以温度升高时,
称为亨利系数。它表示溶质的气化能力,所以温度升高时,![]() 值升高。易溶的溶质,
值升高。易溶的溶质,![]() 较小,故
较小,故![]() 值除与溶剂,溶质性质有关外,还与温度和压力有关。
值除与溶剂,溶质性质有关外,还与温度和压力有关。
由于溶质在溶液中的浓度可分别用mB、cB表示,故亨利定律还可表示为
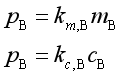
其中![]() 、
、![]() 也是亨利系数,但数值不同,单位也不同。
也是亨利系数,但数值不同,单位也不同。![]() 、
、![]() 、
、![]() 三者关系可由溶质浓度换算关系得到。
三者关系可由溶质浓度换算关系得到。
(七) 理想液态混合物
在一定温度下,液态混合物中的任一组分在全部组成范围内都服从拉乌尔定律,称作理想液态混合物。
由于液态混合物不区分溶质和溶剂,所以其中任一组分的化学势表达式形式都相同,标准态也相同。
式中![]() 表示理想液态混合物中任一组分B的化学势;
表示理想液态混合物中任一组分B的化学势;![]() 表示B的摩尔分数。
表示B的摩尔分数。![]() 是纯B组分在温度为T、压力为p时的化学势,是一个真实存在的状态,它与T、p 有关。
是纯B组分在温度为T、压力为p时的化学势,是一个真实存在的状态,它与T、p 有关。
液体B的标准态是指温度为T,压力为![]() 下的纯液体,
下的纯液体,![]() 是理想液态混合物中任一组分标准态的化学势,它与
是理想液态混合物中任一组分标准态的化学势,它与![]() 不同。但当液体的压力与标准压力相差不大时,可忽略
不同。但当液体的压力与标准压力相差不大时,可忽略![]() 与
与![]() 的差别,此时
的差别,此时![]() 可表示为
可表示为
或以![]() 代替
代替![]() ,即
,即
(八) 理想稀溶液
1. 溶剂的化学势
理想稀溶液的溶剂遵守拉乌尔定律,故理想稀溶液中溶剂的化学势与理想液态混合物中任一组分化学势的表达式相同,即
或
标准态是T,![]() 且服从拉乌尔定律的纯液态溶剂,这是一个真实态,
且服从拉乌尔定律的纯液态溶剂,这是一个真实态,![]() 是标准态的化学势。
是标准态的化学势。
2. 溶质的化学势
理想稀溶液中的溶质服从亨利定律,故其化学势的表达式为
其中
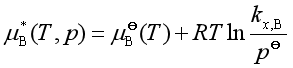
![]() 是
是![]() (纯液体B),且又服从亨利定律那个状态的的化学势,但亨利定律仅在
(纯液体B),且又服从亨利定律那个状态的的化学势,但亨利定律仅在![]() 很小范围才适用,在
很小范围才适用,在 ![]() 时,溶质的行为已经偏离了亨利定律,所以该状态是一个假想态。
时,溶质的行为已经偏离了亨利定律,所以该状态是一个假想态。
理想稀溶液的标准态温度为![]() 、压力为
、压力为![]() ,纯液体B(
,纯液体B(![]() )且服从亨利定律的状态,该标准态显然也是一个假想状态。溶质在该标准态的化学势用
)且服从亨利定律的状态,该标准态显然也是一个假想状态。溶质在该标准态的化学势用![]() 表示,溶质在其标准态时的化学势。
表示,溶质在其标准态时的化学势。![]() 与
与![]() 相差不大时
相差不大时
所以溶质的化学势也可写作
如果溶质的浓度用m或c表示,溶质化学势的表达式相应为
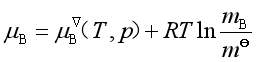 或
或 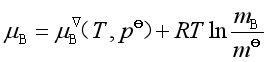
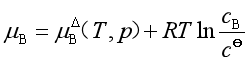 或
或 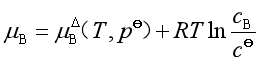
相应的标准态是T,![]() 下,mB =1mol·kg-1(或
下,mB =1mol·kg-1(或![]() =1mol·dm-3)且服从亨利定律的状态,当然,这两个状态也是假想态。
=1mol·dm-3)且服从亨利定律的状态,当然,这两个状态也是假想态。
(九)实际液态混合物和实际溶液的化学势
1. 实际液态混合物
借鉴理想液态混合物中任一组分化学势的表达式,将实际液态混合物中任一组分B的化学势表示为
并定义活度![]() 和活度因子
和活度因子![]() 有如下关系
有如下关系
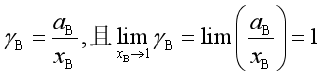
即 ![]()
![]() 是温度T,压力p下,
是温度T,压力p下,![]() ,
,![]() ,即
,即![]() 的那个状态的化学势,该状态即是纯组分B在温度T,压力p时的化学势,是一个真实存在的状态。温度T,压力pө下,
的那个状态的化学势,该状态即是纯组分B在温度T,压力p时的化学势,是一个真实存在的状态。温度T,压力pө下,![]() ,
,![]() ,即
,即![]() 的状态则为实际混合物中组分B的标准态,标准态的化学势为
的状态则为实际混合物中组分B的标准态,标准态的化学势为![]() ,也是一个真实态。
,也是一个真实态。
2. 实际稀溶液
溶剂以拉乌尔定律进行修正,此时溶剂化学势的表达式、活度定义以及标准态都与实际混合物系统中溶剂组分化学势的表达式相同,即溶剂A的化学式为
溶质按亨利定律进行修正,即
所以 ![]()
其中 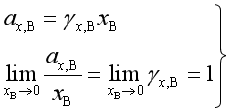
![]() 是溶质浓度用摩尔分数表示时的活度,
是溶质浓度用摩尔分数表示时的活度,![]() 是相应的活度因子。
是相应的活度因子。
溶质的标准态是指定![]() 和
和![]() 下的纯B(
下的纯B(![]() )且又服从亨利定律(
)且又服从亨利定律(![]() )的状态,这个假想状态的化学势是
)的状态,这个假想状态的化学势是![]() ,它与理想稀溶液中溶质在标准态时的化学势一致。
,它与理想稀溶液中溶质在标准态时的化学势一致。
若溶质浓度用质量摩尔浓度m表示时,相应的化学势表达式是
式中 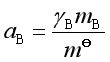
若溶质的浓度用物质的量浓度c表示,实际溶液中B组分的化学势为
式中 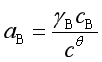
(十) 稀溶液的依数性
1. 饱和蒸汽压下降 ![]()
2. 凝固点降低 ![]() =KfmB,
=KfmB, 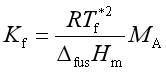
3. 沸点升高 ![]() = KbmB
= KbmB 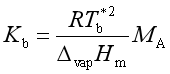
4. 渗透压 ![]()
联系上述四个依数性之间的关系式是
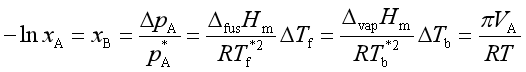
二、重点与难点
1. 化学势是本章的重点,掌握各种系统化学势的表达式是十分重要的。在每一个化学势表达式中,都涉及物质的标准态。为什么要引入标准态,什么是标准态,标准态所蕴含的意义是什么,也是十分重要的。特别是在实际气体和稀溶液中溶质化学势的表达式中所引入的标准态是假想存在的,这比较难以理解,但又很重要,必须掌握。
2. 讨论溶液热力学的实验基础是两条实验定律——拉乌尔定律和亨利定律。要掌握它们的文字叙述和数学表达式以及它们的应用。
3. 在这一章中,重点讨论了两液体形成的理想系统——理想液态混合物和理想稀溶液。这两种系统的定义,各组分化学势的表达式以及化学势表达式导出的它们的性质,都是本章的重点,应熟记表达这些性质的公式,并能熟练应用。
4. 处理实际气体和非理想液态混合物,采用了路易斯提出的方法——保留理想气体和理想液态混合物中组分化学势的表达形式,但对式中的压力及浓度进行修正,即提出了逸度和活度的概念,它们是本章的难点,尤其是活度的计算。对活度计算中的蒸气压法及凝固点下降法应熟练掌握。

