第四章 相平衡
 知识点五:二组分固-液平衡系统
知识点五:二组分固-液平衡系统
如果我们只研究固相与液相的平衡,不考虑气相,这样的研究对象就称为固-液凝聚系统。因压力对凝聚系统的相平衡影响很小,故通常只研究这类系统的恒压相图,此时,相律公式为f*=K- +1,最多的相数是3,最大的自由度数是2,所以常用温度-组成图来描绘二组分凝聚系统的平衡相图。
+1,最多的相数是3,最大的自由度数是2,所以常用温度-组成图来描绘二组分凝聚系统的平衡相图。
这类相图对于生产具有指导作用,例如在制备或纯化某些化合物时,相图可以告诉我们所需要的温度或浓度。在某些操作过程中,相图可指示在什么温度及浓度范围内可避免某些化合物或水化物的固相出现。此外,在合金的制备、金属的富集、超纯提炼和超临界萃取等技术的应用方面选择最适宜的条件。
二组分凝聚系统相图是由实验数据绘制的,对于不同的研究对象,可以采用不同的测定方法,例如对于合金可采用热分析法或电阻法,对于水盐系统,可采用溶解度法。
一、固态完全不互溶系统
1.热分折法绘制相图
热分折法是绘制相图常用的基本方法之一,其做法是将不同组成的样品分别升温至全部熔化,然后让系统缓慢降温,作温度随时间变化的冷却曲线(也称步冷曲线),根据冷却曲线上出现的拐点或平台,判断系统中发生的相变化,并由多条冷却曲线绘制相图。简单低共熔系统及其衍生出来的其它较复杂类型的相图基本上均可采用此法绘制。
现以Bi-Cd系统(图20)为例,说明热分析法绘制相图的基本原理。
(1) 图20中的曲线a是纯Bi的冷却曲线,开始阶段是随着液态Bi的冷却过程,自由度数![]() (为方便对照,图中用*的数目表示),温度均匀下降;至546K时,达到了Bi的凝固点,固态Bi从溶液中析出,两相平衡,自由度数
(为方便对照,图中用*的数目表示),温度均匀下降;至546K时,达到了Bi的凝固点,固态Bi从溶液中析出,两相平衡,自由度数![]() ,释放的凝固热抵消了因冷却而散失的热量,因此温度保持不变,冷却曲线出现平台。因最初非常微细的晶体难以析出,常发生过冷现象而导致冷却曲线上出现最低点。待系统全部凝固成单一固相之后,自由度转变为1,温度继续下降。
,释放的凝固热抵消了因冷却而散失的热量,因此温度保持不变,冷却曲线出现平台。因最初非常微细的晶体难以析出,常发生过冷现象而导致冷却曲线上出现最低点。待系统全部凝固成单一固相之后,自由度转变为1,温度继续下降。
(2) 曲线b是纯Cd的冷却曲线,其形状与曲线a相似,但凝固点为596K。
(3) 曲线c是 wCd=0.2的Bi-Cd混合系统的冷却曲线,系统温度降至C1(在对Bi饱和溶液线TA*E上)时开始有固态Bi析出,两相共存,自由度数![]() ,温度继续下降。但此时固态Bi析出所释放的凝固热部分抵消了降温过程散失的热量,因此降温速度变慢,导致冷却曲线的斜率变小而出现拐点。继续冷却时,随着固态Bi的析出,系统中Cd的含量不断增加,至413K时,液相对Cd也达到饱和,Cd与Bi开始按4:6比例同时大量析出,与先前析出的晶体混合,系统呈三相平衡,
,温度继续下降。但此时固态Bi析出所释放的凝固热部分抵消了降温过程散失的热量,因此降温速度变慢,导致冷却曲线的斜率变小而出现拐点。继续冷却时,随着固态Bi的析出,系统中Cd的含量不断增加,至413K时,液相对Cd也达到饱和,Cd与Bi开始按4:6比例同时大量析出,与先前析出的晶体混合,系统呈三相平衡,![]() ,温度和液相组成均能保持不变,冷却曲线上出现平台。
,温度和液相组成均能保持不变,冷却曲线上出现平台。
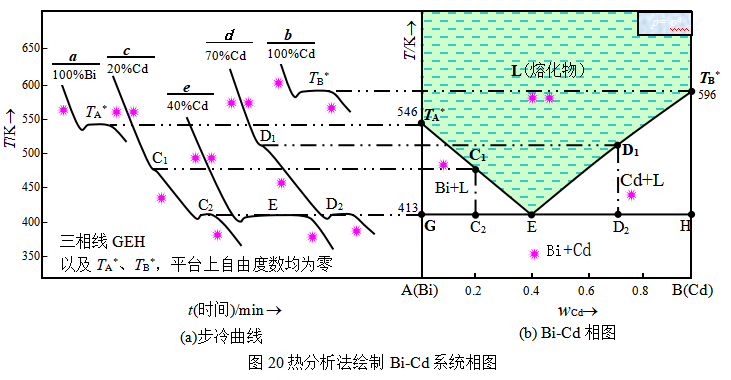
待液相全部凝固后,温度又继续下降。413K时析出的固态Bi和固态Cd的混合物称为低共熔混合物,此时的温度称为低共熔温度。
(4) 曲线d是 wCd=0.7的Bi-Cd混合系统的冷却曲线,它与曲线c类似,只是由于Cd的含量高,随着降温到D1所示温度时,溶液先对Cd饱和,因此拐点处析出的是Cd,继续降温达低共熔点时出现平台, Bi与Cd同时析出形成低共熔混合物。
(5) 曲线e是 wCd=0.4的Bi-Cd混合系统的冷却曲线,该混合物的组成恰好是低共熔混合物的组成,所以降温到低共熔点时,固态Bi和固态Cd同时析出,三相同时共存,![]() ,曲线上出现平台。该冷却曲线的形状与纯物质的相似。
,曲线上出现平台。该冷却曲线的形状与纯物质的相似。
将上述五条曲线的组成和凝固点、拐点及平台对应的温度描绘在温度-组成图上,连接纯物质的熔点、混合物的拐点以及低共熔点,得到Bi的凝固点降低曲线TAC1E和Cd的凝固点降低曲线TBD1E,连接各条冷却曲线上的三相点,得到GEH直线,称为三相线。温度-组成图被分割为四个区域,各区域的相态如图20b所示。此即Bi-Cd二组分相图。
值得一提的是在理想情况下,曲线TAE和ETB,能近似地用下式表示
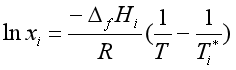 (13)
(13)
式中xi是温度T时组分i在液相中的溶解度,Ti*和ΔH分别是纯组分i的凝固点和摩尔熔化焓。
表5列出了一些简单低共熔系统的实例。
2. 溶解度法绘制相图
某些水-盐平衡系统的相图也具简单低共熔类型特征,在温度不很高的范围内,常采用溶解度法绘制。此方法是根据不同温度下盐的饱和水溶液的浓度数据及相应的固相组成而绘制的。现以在环境湿度影响下易于风化或潮解的水合盐即水-氯化钙系统为例(如图21)。
图中BE线称为盐(CaCl2×6H2O)的溶解度曲线,A是水的冰点,E是冰盐系统三相共存时所能达到的最低温度。图21中,物系点为a的溶液,冷却时沿aN直下,达T2温度(到达Q点)时,开始析出冰,再冷却,进入两相平衡区,与冰平衡的溶液组成沿QE变化,达TE温度时,将同时析出冰和固态CaCl2×6H2O。若希望图中为a的物系在冷却过程中不析出冰,只析出CaCl2×6H2O,则给系统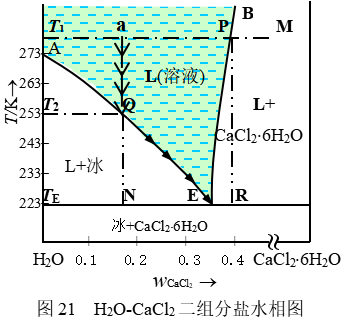 恒温(T1)加热,让水不断蒸发(浓缩过程),使物系点沿水平线aM移动,当到达P点,析出CaCl2×6H2O固体,便可采取冷却步骤,物系点沿PR变化,不断析出固体CaCl2×6H2O(遵循杠杆规则), 直至TE温度,才同时有冰伴随析出。这样析出的固态物质称为低熔冰盐合晶。TE温度为低共熔点,通过E点的水平 线为三相线。
恒温(T1)加热,让水不断蒸发(浓缩过程),使物系点沿水平线aM移动,当到达P点,析出CaCl2×6H2O固体,便可采取冷却步骤,物系点沿PR变化,不断析出固体CaCl2×6H2O(遵循杠杆规则), 直至TE温度,才同时有冰伴随析出。这样析出的固态物质称为低熔冰盐合晶。TE温度为低共熔点,通过E点的水平 线为三相线。
水-盐系统相图有两个重要应用:一是利用低共熔现象获得低温,即只要将足够量的冰、固体盐及水充分混合,并始终保持三相共存,则系统温度会自动降低,直到低共熔点温度。常见的某些水盐系统的低共熔点见表6,由表可见,水与氯化钙系统的低共熔温度较低,并且价格便宜,来源方便,因此,该系统是工业上常用的制冷剂。另一个重要应用是粗盐精制。在较高的温度下,将粗盐溶于水中,使其浓度高于低共熔组成,直接降温可得到精盐。如果在完成纯晶析出后,母液中再加粗盐,重复升温-浓缩-降温析晶-再加粗盐的过程,就可以达到精制盐类的目的。
二、固态部分互溶系统
1.简单低共熔类型
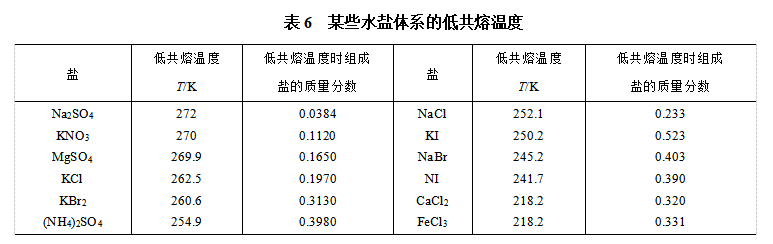
这类相图以简单共晶反应为特征,一般也用热分析法制作相图,也可用差热分析方法或电阻法制作。如图22,是常压下的Pb-Sn相图,此类相图与部分互溶系统的气-液平衡相图相似。Pb-Sn相图的平衡相也已在图中标明,具体分析如下:
(1)面:在TPbETSn以上区,系统为单相熔  液(也称熔体)。a代表Sn在Pb中的固溶体,β代表Pb在Sn中的固溶体,是两个单相固溶体区。单相区内
液(也称熔体)。a代表Sn在Pb中的固溶体,β代表Pb在Sn中的固溶体,是两个单相固溶体区。单相区内 =1,f *=2。
=1,f *=2。
不包括边界线,TPbEC区为固溶体α与熔液L两相共存,TSnED区为固溶体β与熔液L两相共存。在457K以下,α与β两固熔体相共存。两相区内, =2,f *=1,可应用杠杆规则计算两相的质量比。
=2,f *=1,可应用杠杆规则计算两相的质量比。
(2)线:两条垂直线是纯组分Pb和Sn的单相线,TPb与TSn是它们在环境压力下的凝固 点,其上是液相,其下是固相。在恒定压力条件下,熔液冷却曲线会出现(凝固)平台,自由度经历1,0,1的变化。
TPbE是固溶体α的凝固点降低曲线,熔液的凝固点随α固溶体的析出而沿此曲线下降。
TSnE是固溶体β的凝固点降低曲线,熔液的凝固点随β固溶体的析出而沿此曲线下降。
CED为三相线(不包括两端点),线上有两个固溶体α和β共晶,并与熔液(组成为E)共存,此时 =3,f*=0。三相线对应的温度为低共熔点。电器的快速熔断丝就是利用了此低共熔组成的原理。
=3,f*=0。三相线对应的温度为低共熔点。电器的快速熔断丝就是利用了此低共熔组成的原理。
属于此类相图的系统还有:Bi-Pb、Cu-Zn、Ag-Cu、KNO3-NaNO3和AgCl-CuCl等。
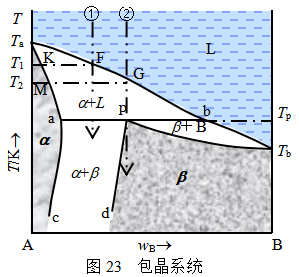 2.具有转变温度类型
2.具有转变温度类型
这类系统在液态完全互溶,在固态部分互溶。形成固溶体α和固溶体β。相图如图23所示。图中Tab,bTb为液相线,与互溶系统的液相线不同.该类系统液相线存在一个奇点,在奇点上液相线的走向发生变化。Taa和pTb为与液相线共存的固相线,ac和pd为一对固溶线。各相区的平衡相态已标注在相图中。
系统①的熔液冷却至T1时,开始析出组成为K的α固溶体。继续冷却,固相组成沿Ka变化,液相组成沿Fb变化。当温度降到Tp时,组成为b的液相与组成为a的固溶体α相发生恒温反应形成β固溶体,该温度即为转变温度。由于固相的转变很慢,常常形成内核是固溶体α,而外壳是固溶体β的包晶结构,所以该转变反应又称作包晶反应。
系统②的熔液,冷却至T2温度,析出成分为M的α固溶体.继续冷却,液相组成沿液相线Gb变化,固相组成沿固相线Ma变化,在包晶反应温度Tp,液相与固溶体α反应生成固溶体β,反应结束时,固溶体α和液相全部转变为固溶体β。
Hg-Cd、AgCl-LiCl、AgNO3-NaNO3等系统的相图也具有上述特征。
三、固态完全互溶系统
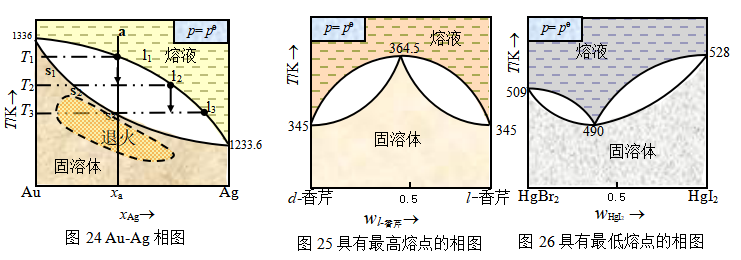
系统中的二个组分不仅在液相中完全互溶,而且在固相中也完全互溶。这类相图与前述理想液态混合物相图类似。Au-Ag、Ca-Ni、Au-Pt、AgCl-NaCl和萘-b萘酚等系统具有这种类型的相图。现讨论Au-Ag相图(图24)。
当组成为xa的系统冷却至T1温度时,开始析出固溶体,其组成为s1,至T2温度,两相平衡共存,液相点为l2,固相点为s2,两相的量可以用杠杆规则计算。如果在冷却过程中始终保持固-液两相的平衡,则随着固溶体的析出,液相组成沿l1 l2 l3变化,固相组成则沿s1 s2 s3变化。为了始终保持冷却过程中两相的平衡,冷却速度要求慢,因速度快会造成固体的析出速率超过固相内部均匀化的扩散速率,晶体内部的成分不均匀,导致每个晶体的内部比外层含较多的高熔点组分,这种现象叫做晶内偏析。这种合金化学混合成分的不均匀会影响合金的性能。改善的措施是将固相的温度保持在略低于熔化温度(图中虚线区,不熔化晶粒)一段相当的时间,使固体内部前后析出的不同组成固相层有充分的时间进行扩散,渐趋平衡。这种方法叫扩散退火,也称均匀化,是金属热处理的一种常用方法。扩散退火时有相的重结晶,通常获得大晶粒,这种大晶粒借助于随后的其它热处理过程可改变成细晶。淬火则相反,令其快速冷却,金属的突然冷却就是迫使它来不及完成平衡态下的相变,冷却至常温后,系统仍能保持高温时的结构状态。
合金、陶瓷和结构材料的许多特性与固体溶液的存在有关,例如钢的硬化和退火就涉及到在不同铁—碳化合物中固体溶液的存在。在高温稳定的固体溶液硬度大,为了保持这种硬度,选取相图所示的适当组成及温度条件,将所得的钢在油或水中急速淬火,使它来不及生成在低温下稳定的固体溶液。把钢再加热到比淬火前略低的温度,使它有机会部分转变成低温较稳定的较软的固体溶液.用此方法可得到不同硬度的钢。退火或者淬火都是金属工艺学方面的重要工序。若金属材料热处理不符合要求时,会导致用该金属制造的配件、机器、交通器材的不良性能,甚至带来意外事故,如飞机的起落架故障等。
晶内偏析现象所造成的结构不均匀,多数情况下是不利的。但有时可利用快速冷却时固相组成的变化滞后现象,从液相中获得较高含量的低熔点物质。如Au-Ag系统,液相中含银量丰富,相对而言固相含金量得以提高。
与理想液态混合物相图应用于分馏原理相似,完全互溶的固-液相图的“分馏”可以熔练并提纯金属(如图4.27所示),通过加温和冷凝,平衡两相中的固相部分总是高熔点组分越来越集中,液相部分是低熔点组分越来越集中,使需提纯的金属与杂质得以分离。方法是将条形金属锭放在管式高温炉中,利用套在管外的可移动加热环,从左端渐渐地向右端移动,如此反复多次,便可达到如同“扫帚”般的功效,将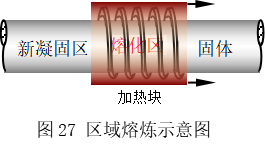 固体中的杂质含量“扫”往右端,左端就得到高纯度金属或者半导体材料(单晶硅的纯度由此可达到9个9,即99.9999999%以上)。这种方法叫做区域熔 炼(zone melting)。区域熔炼也可以用于提纯有机化合物,利用高聚物摩尔质量的不同,它们可以不同的速度随熔化区而移动,从而用区域熔炼法使之逐步分级。可见,区段性地加温、冷凝可以实现金属或有机物的提纯。
固体中的杂质含量“扫”往右端,左端就得到高纯度金属或者半导体材料(单晶硅的纯度由此可达到9个9,即99.9999999%以上)。这种方法叫做区域熔 炼(zone melting)。区域熔炼也可以用于提纯有机化合物,利用高聚物摩尔质量的不同,它们可以不同的速度随熔化区而移动,从而用区域熔炼法使之逐步分级。可见,区段性地加温、冷凝可以实现金属或有机物的提纯。
图25和26类似于具有较大偏差的两个互溶液体及蒸气的相图。在它们的熔点曲线上也呈现有极大或极小值,称为最高恒熔点和最低恒熔点。属于图25类型者例如d-C10H14=NOH-l-C10H14=NOH,相对比较少见。属于图26类型者则有Cu-Au、Mn-Ni、Ag-Sb和KCl-KBr等。
四、有化合物生成的系统
1.生成稳定化合物
如果组成二组分系统的成分A、B能形成稳定的化合物,即化合物在熔化时固液组成相同。那么这种系统的相图,就好象是两个简单的低共熔系统的相图的组合,如图28所示。称这类化合物为相合熔点(或称同成份熔化)化合物。常见系统列于表8。
表8 能形成稳定的化合物的二组分系统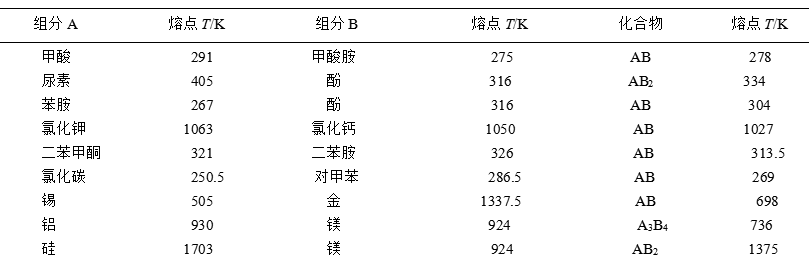
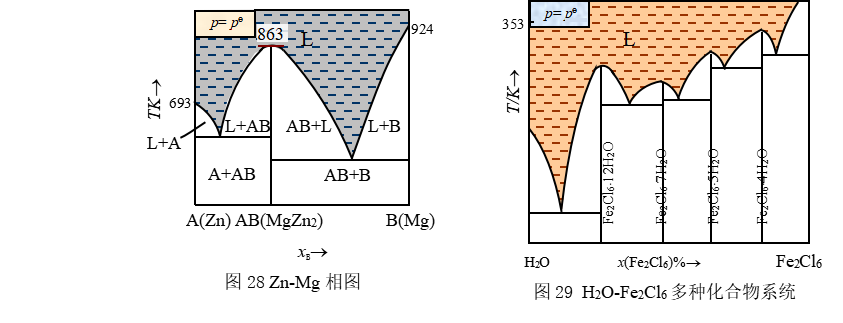
有时,在两个纯组分之间形成不止一种稳定的化合物,如H2O-H2SO4能形成三种化合物(H2SO4×4H2O,H2SO4×2H2O, H2SO4×H2O),可以据此相图,确定各种不同浓度的产品在不同的气温下如何避免运输或者贮藏时发生冷凝结晶的事故。H2O-Fe2Cl6(图29),能形成四种化合物(FeCl3×2H2O,FeCl3×2.5H2O,FeCl3×3.5H2O,FeCl3×6H2O),若化合物数目有n种,则其相图就被看作是由(n+1)个简单低共熔系统的相图组合而成的,仅化合物熔点处切线(如图28中标注86.3处)为零,显然![]() ,因而作图有圆滑转折,这是与简单相图纯物质熔点处切线不为零,
,因而作图有圆滑转折,这是与简单相图纯物质熔点处切线不为零,![]() ,因而有明显折点的情况有区别)。
,因而有明显折点的情况有区别)。
2 生成不稳定化合物
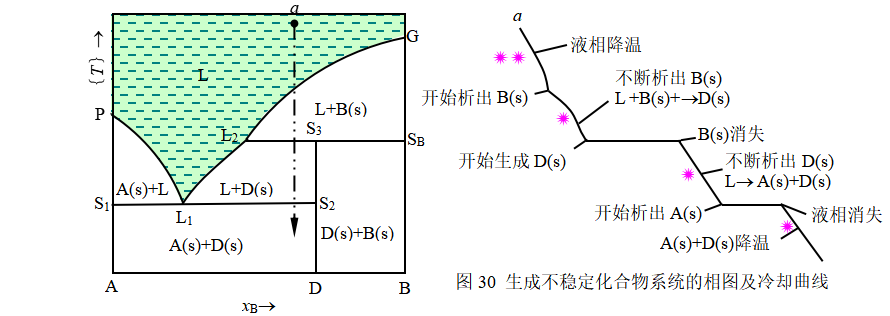
若A及B两物质所生成的化合物只能在固态时存在,将其加热到某—温度时,它就分 解成另一种固态物质和液相,而且液相的组成完全不同于固态化合物的组成,我们称这类系统为生成不稳定化合物的系统。这类系统最简单的是不稳定化合物与生成它的两种物质在固态时完全不互溶,其相图如图30所示。
若将不稳定化合物D(s)加热,系统点由D垂直向上移动,达到相当于S3点所对应的温度时,化合物开始分解成B(s)及相点为L2的液相,即
所产生的固液两相的质量比符合杠杆规则,即m(L2)/m(SB)=S3SB/L2S3。水平线段L2SB所对应的温度称为不相合熔点或转熔温度。在此温度,三相共存,f *=0,三相的组成及温度皆为定值,直到加热至D(s)完全分解,温度才开始上升。再继续加热,B(s)将不断地熔化,对应的液相组成将沿着L2G曲线移动,直至B(s)消失,液相点与系统点重合。以后则是液相的升温过程。
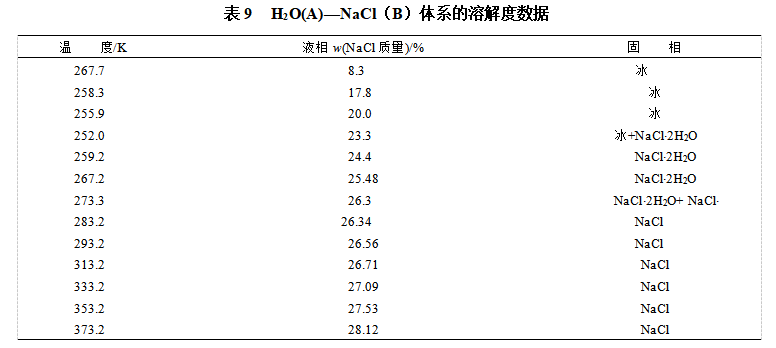
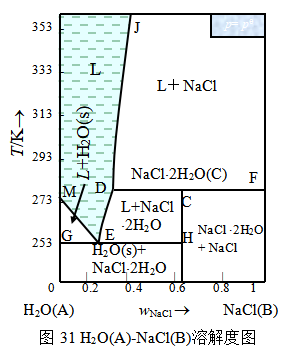
由表9数据绘得的H2O(A)-NaCl(B)系统的相图如图31所示,NaCl与H2O能形成化合物NaCl×2H2O(C),该化合物在温度达273.3K时就分解:
![]()
也即液相中该化合物不能稳定存在,所以属于不稳定化合物。图中DCF线为NaCl、水合盐NaCl×2H2O(s)及组成为相点D所示的溶液三相平衡线,在此线温度下NaCl×2H2O(s)和与它平衡的液相组成不一样,故此温度即为不相合熔点;GEH线也为三相平衡线,即H2O(s)、水合盐NaC1×2H2O(s)及具有低共熔点E组成的溶液。其他各相区相态则如图所示。在二组分系统 相图中,凡有“T”字形的图形出现,就表示有不稳定化合物生成。
这一类系统的实例有:Au-Sb,SiO2—A12O3、H2O-NaSO4和KCl-CuCl2等。
实际上,在同一个二组分凝聚系统的相图中,既可出现液态部分互溶,也可出现固态部分互溶;既可存在稳定化合物,也可存在不稳定化合物;既可存在固态完全不互溶,也可存在固态完全互溶。总之,由上述简单相图可以组合成各式各样的复杂相图。
以上所述是各种典型二组分凝聚系统相图最简单的情况。并不反映整个凝聚系统相图全貌(例如还有受空气压力和环境湿度影响的固-气类相图)。
例5 试讨论图32(a)所示的二组分系统:
(1)它是由哪二类相图组合而成的?试标出各相区的相态。
(2)a、b两系统点降温时所经历的自由度变化。
(3)若将30g恒沸混合物降温,先析出何种固体?求出最大析出量。
(4)由图设计出一个将恒沸混合物分离为纯A纯B的方案。
最低恒沸点组成:质量分数含w(B)=0.30;低共熔点组成 :质量分数含w(B)=0.70
解 (1)该相图是由具有最低恒沸点的双液系和简单低共熔凝聚系统组合而成的气-液-固平衡相图。图4.32(a)中各区的相态:1.气相 2.气相+溶液 3.溶液 4.溶液+固相B 5.固体A+固体B 6.溶液+固相A 7.溶液+固相A
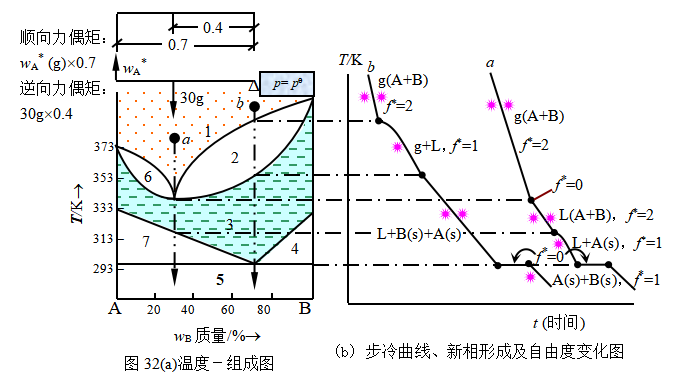
(2) 图4.32(b)描绘了步冷曲线、转折点、自由度数变化和各阶段存在的相。
(3) 析出A(s),据力偶矩图或杠杆规则,析出最大量为wA*=30gx0.4/0.70=17g
(4) 将恒沸混合物冷至接近293K时分离出A(s)后,再将剩下含B70%的低共溶混合物溶液升温蒸馏(工业上采取减压蒸馏),釜底可得纯B,馏出液为恒沸混合物,重复上述操作,直到A、B完全分离。
讨论:此类具有恒沸混合物的系统,不能单纯依靠气-液平衡使A、B完全分离,需降温至凝聚相产生,利用气-液和液-固平衡系统的联合相图,采取结晶与蒸馏结合的方法进行分离,才可以得到纯A和纯B。
例6 图33(a)为Hg-Cd的T-wB(温度-组成)图:
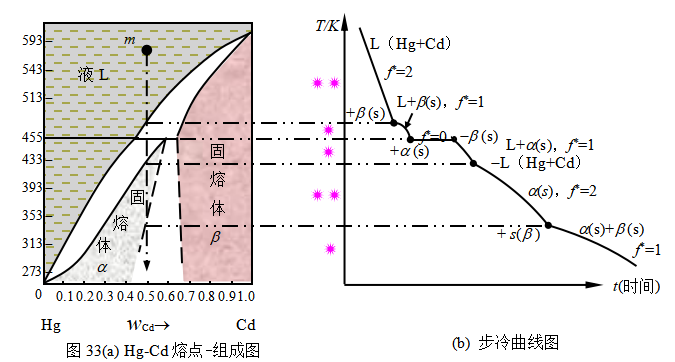
(1)画出系统点为m,组成为含镉质量分数wCd=0.5的混合物从573K开始冷却的步冷曲线。并标明:
①系统在冷却过程中自由度的每一次变化。
②在每一个转折点或平台处出现或消失的物相。
(2)解释系统冷却至水平线上时存在的平衡物相名称及其化学反应式。
(3)利用相图解释镉汞齐电极的浓度控制镉的质量分数在0.05~0.14之间的意义。
解(1)步冷曲线、自由度、相变情况如图33(b)。
(2)系统冷却至水平线上时形成一液(Hg-Cd完全互溶液)二固(α和β二固溶体)平衡共存的状态。化学反应式:L(液)+β(固溶体)![]() α(固溶体)
α(固溶体)
(3)保持常温下,镉汞齐电极处于熔液L与固溶体之间的二相平衡,其中的镉在L及α二相中都达到饱和,均有一定的浓度,如果系统中Cd的含量发生少许变化,即系统点在水平方向改变时所对应的两个相点不变,即两相的组成不变。因电极电势取决于两相的组成,所以电极电势可以保持恒定。
