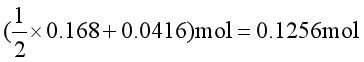第五章 化学平衡
 知识点六:同时平衡与反应的耦合
知识点六:同时平衡与反应的耦合
一、同时平衡的定义
在一个化学反应系统中,往往有几个反应同时进行(特别是在有机反应中)。这些反应有时是平行进行,有时是连串进行,彼此间有一种或一种以上相同的反应物或产物,当系统达到平衡时,它们相互之间有一定的关系,这一类平衡叫作同时平衡。例如,C2H5OH脱水脱氢系统便是
↗ C2H4+H2O
C2H5OH
↘ CH3CHO+H2
对同时平衡系统,也是应用吉布斯自由能判据来判断过程进行的方向和限度。但为了方便,一般还引入反应的亲和势。
二、反应的亲和势、同时平衡判据和反应的耦合
前面已经谈到,若在封闭系统中在等温等压条件下进行了单位反应进度时,其吉布斯自由能变化
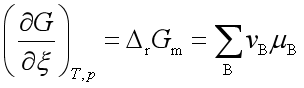
令 ![]() = A (42)
= A (42)
A就称为反应的亲和势,它最初是由德唐德提出的。
由亲和势定义式得知
![]() A
A![]() (43)
(43)
由于![]() <0,反应能自发的向右进行,故可知
<0,反应能自发的向右进行,故可知
A>0 反应能自发的自左向右进行;
A<0 反应不能自发的自左向右进行;
A=0 系统达到平衡。
若系统中有若干个反应进行,其吉布斯自由能变化为
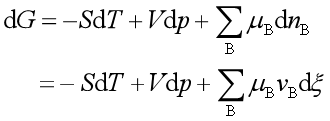
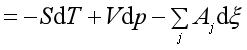 (44)
(44)
若整个系统在等温等压下同时平衡,则有
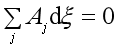 (45)
(45)
若整个系统中反应自发进行,据(44),应有
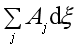 >0 (46)
>0 (46)
上式说明反应自发进行的方向和限度是由式(45)和(46)两式决定的,(45)说明若系统达到同时平衡,则每个反应的亲和势都应为0,即![]() 。而(46)说明,若系统的
。而(46)说明,若系统的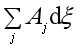 >0,则整个反应就能自发进行,不管其中是否有A<0的反应。
>0,则整个反应就能自发进行,不管其中是否有A<0的反应。
如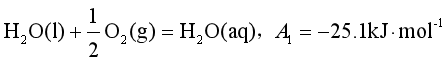 。因此它是不能自发进行的,但若系统中同时有锌的氧化反应存在,则两个反应都能自发进行,因为锌氧化成ZnO反应的
。因此它是不能自发进行的,但若系统中同时有锌的氧化反应存在,则两个反应都能自发进行,因为锌氧化成ZnO反应的![]()
即 ①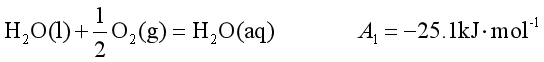
②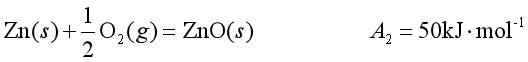
总结果是![]() >0,整个系统都能自发进行,好像是反应②带动反应①,这称为反应的“耦合”或(耦联)。
>0,整个系统都能自发进行,好像是反应②带动反应①,这称为反应的“耦合”或(耦联)。
综上所述,对于达到同时平衡来说,要使多个反应系统自发进行,只需计算![]() 总和就行,当
总和就行,当 >0反应系统自发进行。
>0反应系统自发进行。
三、同时平衡的计算
1.计算原则
当系统处于同时平衡时,对所有在该系统进行的反应来说,每一种反应物的浓度(或活度或分压)都应该是同一数值,这就是同时平衡的计算原则。
同时平衡有三种常用的计算方法,即代数法,图解法和反应进度法,现只介绍代数法。
2.代数法计算同时平衡
代数法适用于反应不太复杂的情况。
例6 298K时下列反应
① NH4CO2NH2(s)= 2NH3(g) + CO2(g)
② LiCl·3NH3(s)= LiClNH3(s) + 2 NH3(g)
离解的平衡压力分别为反应①11.85kPa和反应②17.02kPa。求:
(1)以上两反应的平衡常数![]() 和
和![]() 。
。
(2)略去固体所占体积,将0.05mol CO2(g)和0.2mol LiCl·3NH3(s)置于24.4dm3真空容器中,计算298K达平衡时的总压。
(3)求平衡时各相的物质的量。
解 (1)
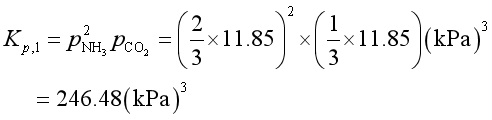
![]()
(2)当LiCl·3NH3在24.4dm3真空容器中分解时,分解所得NH3其压力为![]() ,分解出的NH3与通入的CO2作用生成NH4CO2NH2,从而系统达到①和②的同时平衡,此时, ①,②反应的NH3分压应该一样。
,分解出的NH3与通入的CO2作用生成NH4CO2NH2,从而系统达到①和②的同时平衡,此时, ①,②反应的NH3分压应该一样。
所以 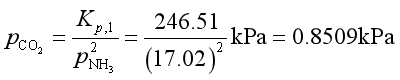
得系统总压力为 ![]()
(3)平衡时气相中
物质的量 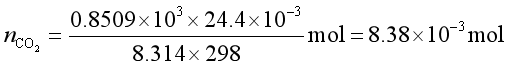
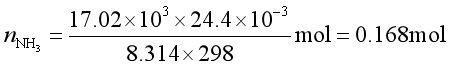
气相总的物质的量为 ![]()
反应掉的CO2的物质的量为 ![]()
故生成的NH4CO2NH2也为![]() 。
。
对反应②而言,平衡时氨的物质的量是0.168mol,但这不是LiCl·3NH3(s)的消耗数,因为已经有一部分NH3与CO2生成NH4CO2NH2(s)了。所以剩余的LiCl·3NH3(s)的物质的量应为
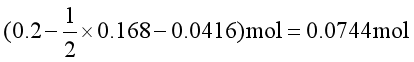
由反应②反应物分解所得LiClNH3(s)的物质的量应为