问题一:设有可逆反应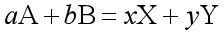 ,在等温等压下反应达到平衡时,反应进度
,在等温等压下反应达到平衡时,反应进度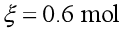 ,则此反应的
,则此反应的 是否是由起始到平衡过程中吉布斯自由能的改变?
是否是由起始到平衡过程中吉布斯自由能的改变? 的单位是什么?
的单位是什么?
回答:
![]() 不是由起始到平衡过程中吉布斯自由能的改变,是反应各物质组成不变(即化学势不变)条件下发生
不是由起始到平衡过程中吉布斯自由能的改变,是反应各物质组成不变(即化学势不变)条件下发生![]() 时系统吉布斯自由能的改变,也可以理解为反应某时刻系统自由能对反应进度的变化率,
时系统吉布斯自由能的改变,也可以理解为反应某时刻系统自由能对反应进度的变化率,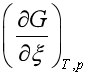 ,其单位为
,其单位为![]() 或
或 ![]() 。
。
问题二:“化学反应自由能是产物与反应物之间的吉布斯自由能的差值。”该说法对吗?
回答:
错误的。反应自由能![]() 是反应组分组成不变(即化学势不变)条件下发生
是反应组分组成不变(即化学势不变)条件下发生![]() 时系统吉布斯自由能的改变,或者理解为反应某时刻系统自由能G对反应进度
时系统吉布斯自由能的改变,或者理解为反应某时刻系统自由能G对反应进度![]() 的变化率,不是产物(终态)与反应物(始态)之间的吉布斯函数的差值。
的变化率,不是产物(终态)与反应物(始态)之间的吉布斯函数的差值。
问题三:在等温、等压下,一个化学反应之所以能自发进行,是由于反应物的化学势总和大于产物的化学势总和,那么封闭系统中为什么反应总不能进行到底,而要达到平衡态?
回答:
在等温、等压下,一个化学反应之所以能自发进行,是由于反应物化学势总和大于产物化学势总和,即
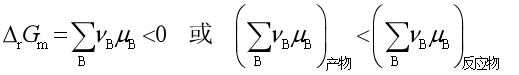
虽然反应物化学势总和总是大于产物化学势总和,一般反应也是不能进行到底的,其原因是在反应过程中,反应物、产物相互混合,产生混合熵,ΔmixS>0,由于ΔG=ΔH-TΔS,系统的自由能G降低,导致G—ξ直线变为G—ξ曲线,如图1所示。自由能G具有极小值,系统自由能降到极小值点就不再改变,反应达到某一个平衡态,反应物不能完全变成产物。
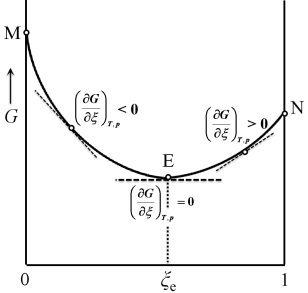
图1 反应系统G随反应进度ξ的变化
问题四:为什么有的化学反应不能进行到底,有的化学反应能进行到底?
回答:
对于封闭系统中发生的反应,由于反应物与产物混合,产生混合熵、混合自由能,使系统的吉布斯自由能降低,系统的自由能存在一个极小值点,反应过程中系统自由能降到极小值点就停止变化,到达一个平衡状态,不能进行到底。如果反应过程中反应物与产物不混合,反应就可能进行到底的。例如,常压下, 900 ℃时,在空气中煅烧石灰石反应: CaCO3 (s)=CaO (s) + CO2 (g),反应物质都是以纯态存在,彼此不混合。当空气中CO2分压小于CaCO3 (s)的分解压力,建立不起平衡,分解反就能一直进行到底。
问题五:化学反应达到平衡时,宏观状态和微观状态特征有何区别?
回答:
反应到达平衡时,宏观上反应物和产物的数量不再随时间而变化,好像反应停止了。而微观上,反应仍在不断地进行,反应物分子变为产物分子,而产物分子又不断变成反应物分子,只是正、逆反应的速率恰好相等,使反应物和产物的数量不再随时间而改变。
问题六:什么是化学反应的亲和势?它与18、19世纪间曾盛行过的化学亲和力学说有什么关系?
回答:
我们现在所说的化学反应的亲和势,是过去化学亲和力学说发展的延续,它们之间在具体内容上已有质的区别,但都是研究化学平衡问题,回答反应发生的方向与限度的问题。早期的化学工作者,于18世纪后半期,在接受了炼金术土影响的基础上,认为化学反应发生的原因是反应物之间存在着“爱力”,他们进行各种实验,力图求出不同反应物之间的那种亲和力,但在19世纪初的半个世纪里,这方面没有任何重大进展,后来凯库勒等人把亲和力学说发展为化学键理论。在19世纪50到60年代,汤姆生与贝塞罗用化学反应的热效应来解释反应的方向性,他们认为反应热效应是反应物间化学亲和力的量度,直到吉布斯提出热力学势(化学势)的概念和理论之后,人们才可能将热力学用于处理多组分的多相系统,建立起现代化学平衡理论。 De Donder(德唐德)首先把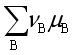 的负值定义为化学亲和势A:
的负值定义为化学亲和势A:
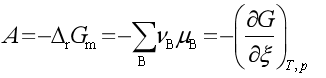
当反应向生成产物的方向自发进行时,A> 0,反应具有正向推动力。
问题七:在一定温度下,对应同一计量方程某气体反应的标准平衡常数为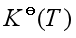 ,若气体混合物开始组成不同时,
,若气体混合物开始组成不同时,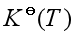 是否相同?平衡时其组成是否相同?
是否相同?平衡时其组成是否相同?
回答:
![]() 只是温度的函数,在一定温度下,对应同一计量方程,
只是温度的函数,在一定温度下,对应同一计量方程,![]() 不因气体反应系统的组成而改变,因此是定值,反应气体混合物开始组成不同,到达平衡时平衡时,平衡态组成不会因其改变而不同。
不因气体反应系统的组成而改变,因此是定值,反应气体混合物开始组成不同,到达平衡时平衡时,平衡态组成不会因其改变而不同。
问题八:若化学势选择不同的标准态,则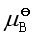 的值就不同,所以反应的
的值就不同,所以反应的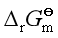 也会改变,由等温方程
也会改变,由等温方程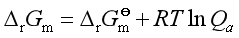 ,那么
,那么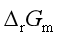 也会变,这样认为对吗?为什么?
也会变,这样认为对吗?为什么?
回答:
这样认为不对,![]() 不会改变。虽然化学势选择不同的标准态,
不会改变。虽然化学势选择不同的标准态,![]() 的值不同,但因
的值不同,但因![]() ,活度
,活度![]() 随之改变,两者改变的影响刚好抵消,即各物质的化学势
随之改变,两者改变的影响刚好抵消,即各物质的化学势![]() 并不因选择标准态不同而改变。所以
并不因选择标准态不同而改变。所以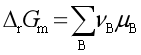 不会改变。
不会改变。

