当前位置:课程学习>>第六章 化学动力学基础>>知识讲解>>视频课堂>>知识点五
知识点五:温度对反应速率的影响
1884年,范特霍夫提出如下规则:
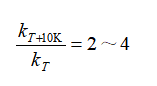
按此式可粗略估计温度对反应速率的影响。
一、阿累尼乌斯方程式
1889年:![]() 提出经验式:
提出经验式:
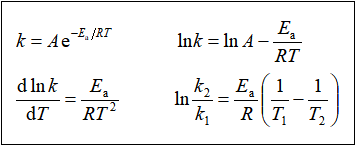
![]()
![]() :指前因子或频率因子
:指前因子或频率因子
![]() :阿累尼乌斯活化能,单位:
:阿累尼乌斯活化能,单位: ![]() 。
。
适用条件:适用于 ![]() 的化学反应。
的化学反应。
【思考题】大多数化学反应的活化能 ![]() ~
~![]() ,在常温下
,在常温下![]() ,试用阿累尼乌斯公式验证范特霍夫规则。
,试用阿累尼乌斯公式验证范特霍夫规则。
二、反应速率与温度的几种类型

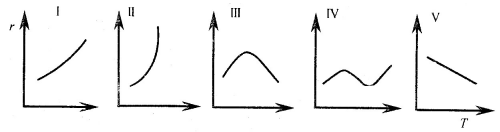
Ⅰ:阿伦尼乌斯型; Ⅱ:爆炸极限反应;
Ⅲ:酶催化或受吸附制约的多相催化反应;
Ⅳ:某些烃类气相氧化、煤的氧化等反应;
Ⅴ:如![]() 。
。
三、活化能对反应速率的影响
通常化学反应的活化能Ea= 40~400 kJ·mol-1,其中60~250 kJ·mol-1居多。
![]()
(1)活化能越大,反应速率越小。
Ea < 40 kJ·mol-1,速率很快,室温下反应瞬间完成。Ea > 100 kJ·mol-1,速率慢,反应需要适当加热。
设Ea = 50 kJ·mol-1,温度从300 K 升至310 K:
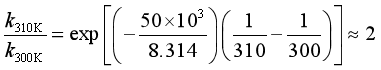
设Ea = 100 kJ·mol-1,温度从300 K 升至310 K:
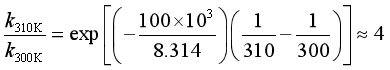
(2)对于Ea不同的反应1和2,设 E1 > E2 :
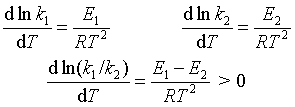
即高温有利于活化能较大的反应。
(3)对于给定的某一反应,设 T1 <T2 :
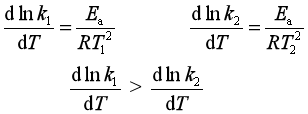
即在低温范围,反应速率对温度的变化更敏感。
接下来让我们进行下一部分的学习
