当前位置:课程学习>>第六章 化学动力学基础>>知识讲解>>视频课堂>>知识点八
知识点八:反应速率理论
一、简单碰撞理论
理论要点:化学反应的首先条件是反应物分子间的相互碰撞,但并非所有的碰撞都能发生反应,只有碰撞分子对在碰撞连心线上的相对平均能![]() 大于某一临界值
大于某一临界值![]() 时才能导致反应的发生。
时才能导致反应的发生。
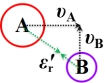
碰撞时A相对B的速度υAB :

以双分子基元反应为例
![]()
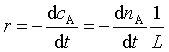
定义有效碰撞分数
则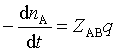
1、碰撞频率 ![]()
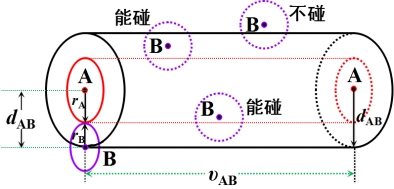
![]()
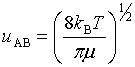
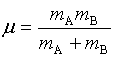
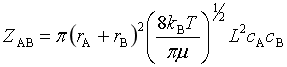
2、反应碰撞分数(q)
![]()
![]() 为
为![]() 分子发生有效碰撞时,连心线上相对平动能应具有的最小值,称为临界能或阈能。
分子发生有效碰撞时,连心线上相对平动能应具有的最小值,称为临界能或阈能。
3、反应速率系数(k)
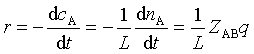
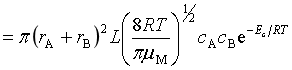
与二级反应速率方程![]() 比较,得
比较,得

4、与阿累尼乌斯公式的比较
阿氏公式:![]()
碰撞理论:![]()
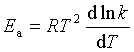
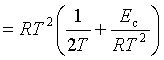
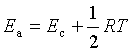
5、方位因子![]()
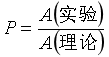
通常情况下,![]() <
<![]() ,即
,即![]() (实验)<
(实验)<![]() (理论)。原因:(1)方位因素;(2)能量传递速率因素。
(理论)。原因:(1)方位因素;(2)能量传递速率因素。
考虑方位因子后,碰撞理论的速率系数表示为:
![]()
6、理论评价
成功之处:(1)突出了分子碰撞和需要能量以克服能峰的主要特点,模型清晰简单;(2)解释了质量作用定律和阿氏公式成立的原因,找出了![]() 与温度的关系等。
与温度的关系等。
不足之处:(1)不能预言![]() 的大小;(2)
的大小;(2)![]() 的物理意义不明确。
的物理意义不明确。
接下来让我们进行下一部分的学习
