当前位置:课程学习>>第六章 化学动力学基础>>知识讲解>>视频课堂>>知识点九
知识点九:催化反应
一、催化作用基本原理
(1)催化剂的概念:能显著加快反应速率,而本身的化学性质和数量在反应前后都不改变的物质。
催化作用:
自身催化作用: ![]()
(2)催化作用的实例:
反应 催化剂

![]()
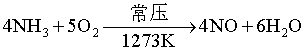
![]()
![]()
![]()
(3)催化作用的分类

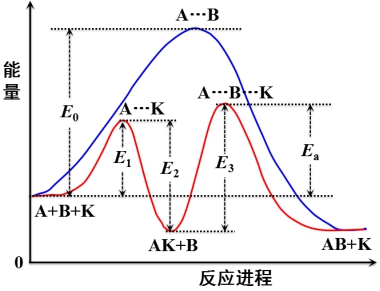
(4)催化作用原理
催化剂和反应物作用,形成了不稳定的中间产物,改变了反应途径,降低了活化能,从而使反应速率加快。
某一反应: ![]()
催化剂![]() 反应机理:
反应机理:
![]() 快
快
![]() 慢
慢
用“平衡假设”法处理:
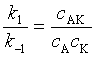
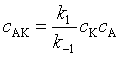
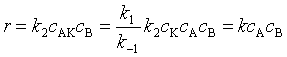
式中 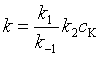
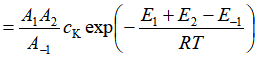
与 ![]() 比较,得
比较,得
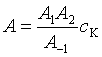
![]()
有些催化反应,活化能降低并不多,但反应速率却增加很大。可归结为活化熵的影响,即催化剂能使频率因子增加,从而加快反应。
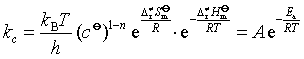
二、催化剂的基本特征
(1)物理性质的改变。
(2)不改变热力学平衡。
![]() ,
,![]() ,
,![]() 和
和 ![]() 以相同的倍数增加。用途是寻找催化剂。
以相同的倍数增加。用途是寻找催化剂。
接下来让我们进行下一部分的学习
