第六章 化学动力学基础
 知识点九:催化反应
知识点九:催化反应
在一个化学反应系统中加入少量某种物质(可以是一种到几种),若能显著增加反应速率,而其本身的化学性质和数量在反应前后都不发生变化,则该物质为这一反应的“催化剂”。有催化剂参加的反应称为“催化反应”。减慢反应速率的物质,称为阻化剂。
与温度和浓度一样,催化剂只是影响化学反应速率的一种因素。大量事实表明,添加催化剂是加快反应速率的最有效的方法之一,这就是目前80%-90%的化工生产中的化学反应都涉及使用催化剂的原因。人们熟知的反应如合成氨、制备硫酸、硝酸、合成氯乙烯、苯乙烯以及高分子的聚合反应等都离不开催化剂。生物体赖以生存的一切化学反应都是催化反应,如植物的光合作用,有机体的新陈代谢作用,蛋白质、碳水化合物、脂肪等的分解作用等都与催化作用有关。除此之外,在寻求化学原料转化的新途径和开发可以取代“化石燃料”的新能源过程中;在解决全球范围内的一系列与环境保护有关的新问题时;在为化工生产中的化学反应寻找无毒无害的环境友好催化剂中;甚至在家庭使用的电器等生活用品中,都正在广泛使用和开发催化剂,形成了环保催化、能源催化、绿色催化、家庭用催化等许多应用新领域。
催化反应可分为三类:一是催化剂与反应物质处于同一相中所进行的反应称为均相催化反应;二是催化剂与反应物质不在同一相中,反应在两相界面上进行的反应的称为多相催化反应;三是生物催化,即酶催化反应。这三类催化反应的机理各不相同,但它们有若干基本的共同点,即催化反应的基本原理。
一、催化反应的基本原理
催化剂之所以能改变反应速率,是由于催化剂和反应物作用,形成不稳定中间产物,改变了反应途径,降低了活化能,从而使反应加速。表7为不同催化剂下H2O2分解反应的活化能数据。
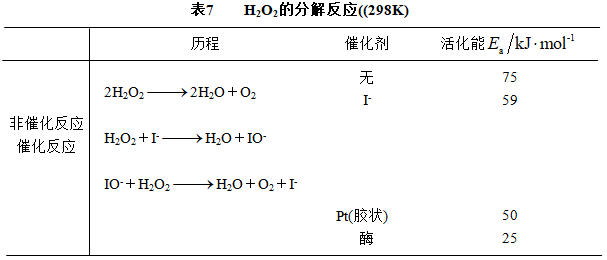
根据阿仑尼乌斯公式,若催化剂能改变活化能或指前参量(或两者同时改变),反应速率都会变化,但降低活化能对反应速率影响更大。从表7看出,催化反应的活化能比非催化反应的活化能小,不同催化剂作用下反应活化能也不相同。对H2O2的分解反应,若在298K时用I- 催化,假设指前参量相等,用阿仑尼乌斯公式可计算出 k催化/k非催化=638。有催化剂存在的化学反应,会沿着活化能较低的新途径进行,
设有反应 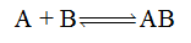
有催化剂时,反应途径为
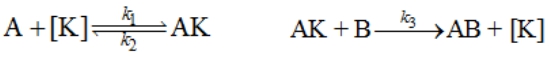
![]()
式中,[K]表示催化剂,AK表示中间产物,假设第一步是快速平衡,第二步是速控步骤,用平衡假设处理,可得反应速率
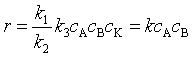
其中 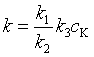 。当各基元反应的速率常数可用阿仑尼乌斯公式表示时,可求得催化反应的表观活化能
。当各基元反应的速率常数可用阿仑尼乌斯公式表示时,可求得催化反应的表观活化能![]() 。
。
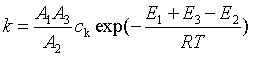
即 ![]()
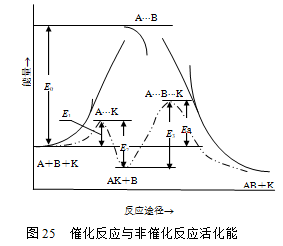
图25为催化与非催化反应的能垒示意图。从图中可见非催化反应要克服活化能![]() 的高能垒,而在催化剂存在时,反应途径改变了,只需克服两个较小的能垒(E1和E3),通常E1、E2、E3的数值均比
的高能垒,而在催化剂存在时,反应途径改变了,只需克服两个较小的能垒(E1和E3),通常E1、E2、E3的数值均比![]() 小,故催化反应的总活化能比非催化反应的总活化能小。
小,故催化反应的总活化能比非催化反应的总活化能小。
催化剂能改变指前参量A。有些催化反应,活化能降低并不多,但反应速率却增加很大,主要原因应归于活化熵的影响。根据(96)及(103)式,若将![]() 视为反应活化能,则活化熵
视为反应活化能,则活化熵![]() 的增大,导致指前参量增大,从而加快了反应速率。
的增大,导致指前参量增大,从而加快了反应速率。
实验证明,对某些反应,使用不同的催化剂,活化能基本不变,但由于指前参量A的增加,从而使反应速率加快。表8为丙酮碘化反应中指前参量A的变化对反应速率的影响。 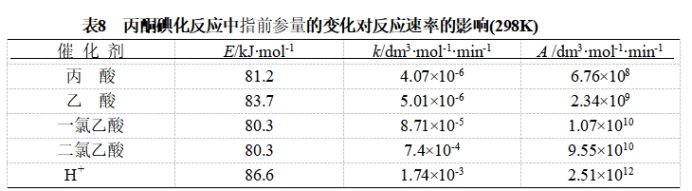
综上所述,催化剂具有以下基本特征:
(1)催化剂能改变反应途径,降低反应活化能,从而加快反应到达平衡的时间。对某些反应,当催化剂的加入使指前参量增加时,也可以使反应速率加快。
(2)催化剂在反应前后,常有物理性质的改变,但其化学性质和数量不发生变化,并在反应过程中参与了反应(与反应物生成不稳定的中间配合物)。
(3)催化剂只能缩短到达平衡所需的时间,而不能改变化学反应的方向和限度。催化剂不会改变反应系统的始终状态,即不会改变△rGm。所以催化剂只能使△rGm<0的反应加速进行,直到△rGm = 0,即反应达到平衡为止。显然催化剂不能改变平衡常数,即催化剂不能改变化学反应的限度。由于平衡常数为正、逆反应的速率常数之比,所以催化剂必以相同的倍数加快正、逆反应的速率,这一规律为研究开发催化剂提供了一种途径。
(4)催化剂对系统中存在的某些少量杂质极其敏感,这些物质可以强烈地影响催化剂的活性、结构、稳定性等,有的可起助催化作用、有的起毒害作用。
(5)催化剂具有特殊的选择性。催化剂的选择性有两个方面的含义:一是指不同类型的反应需要选择不同的催化剂。例如脱氢反应的催化剂和氧化反应的催化剂是不同的;即使是同一类型的反应,其催化剂也不一定相同,像乙烯的氧化和二氧化硫的氧化所用的催化剂也不同,前者用银催化剂,后者用钒催化剂。又如某一物质只能在某一固定类型的反应中,才可作为催化剂,这一点在酶催化中表现得最为突出,脲酶仅能催化尿素转化为氨及CO2,而对其它反应并无催化活性。二是指对于同样的反应物选择不同的催化剂可以获得不同的产物,这一点对生产实际有重要意义。因为我们可以从简单易得的原料采用不同催化剂来获得各种需要产品,例如采用不同的催化剂可以利用乙醇得到多达25种化工基本原料。图26为乙醇在不同的催化剂及反应条件下的部分转化产物。
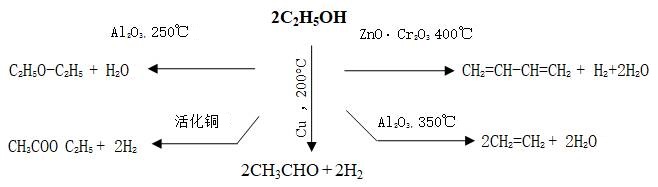
图26 乙醇在不同的催化剂下转化产物
利用催化剂的特殊选择性可加速主反应的速率,从而抑制副反应的进行。因此在评选催化剂时希望其选择性愈高愈好。工业上通常用下式来定义催化剂的选择性
选择性=(转化为目标产物的原料量/原料总的转化量)×100%
催化剂用量是任意的。通常用 ![]() 表示催化剂的比催化活性(
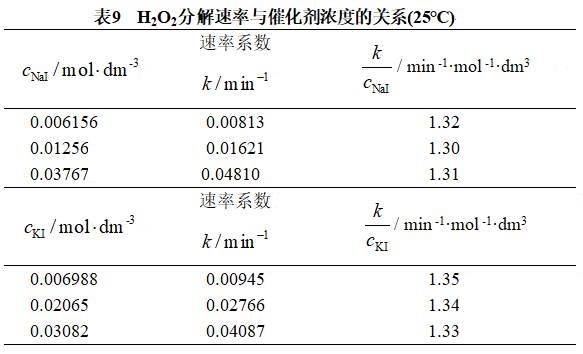
表示催化剂的比催化活性(![]() 表示催化剂的浓度)。比催化活性的大小取决于催化剂的本性,与其用量无关。这一点可以从表9 看出。
表示催化剂的浓度)。比催化活性的大小取决于催化剂的本性,与其用量无关。这一点可以从表9 看出。
对多相反应来讲,催化剂的表面积是决定催化剂活性的一个主要因素,当催化剂的组成和数量确定后,其表面积越大,活性越高,故常将催化剂制成多孔状或选用多孔物质做催化剂的载体。例如铂催化H2O2分解的催化活性按块状→ 丝状→ 粉状→ 铂黑(胶体分散状)的顺序增大。凡是使催化剂面积减少的因素,均会减低催化剂的活性,如催化剂在高温下烧结,污物沉积,或某些杂质(或副产物甚至产物)强烈吸附于催化剂表面(称“中毒”)等,都会使催化剂失去活性。