同学们,本栏目是对你们学过的知识和生活中常见问题的归纳。其中,有一些共性问题,也许你会需要哦!
让我来帮你解决常见问题!
问题一:电池中正极、负极、阴极、阳极的分别是如何命名的?为什么在原电池中负极就是阳极,正极就是阴极?对电解池来说,负极就是阴极、正极就是阳极?
回答:
电极的命名有两种方法,一种是按电势高低来命名,电势高的电极称为正极,电势低的电极称为负极,电流总是从电势高的正极流向电势低的负极,电子的流向与电流的流向刚好相反,是从负极流向正极,另一种是按电极反应类型来命名,发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。
对原电池来说,负极电势低,正极电势高,电池放电时,电池反应是自动发生,化学能转化为电能,负极上发生氧化反应,正极上发生还原反应,按电极命名方法,因此负极就是阳极、正极就是阴极,对电解池来说,与外电源负极相接的电极电势低,并且发生的是还原反应,按电极两种命名方法,是负极也是阴极,与外电源正极相接的电极电势高,并且发生的是氧化反应,是正极也是阳极。
目前也有一些电化学书上采用公认的约定:无论是电解池,还是原电池,在讨论单个电极时,把发生氧化反应作用的电极称为阳极;把发生还原作用的电极称为阴极。
问题二:电子导体(金属)和离子导体(电解质溶液)的导电本质有何不同?电解质溶液导电的特点是什么?
回答:
电子导体导电本质是靠导体中自由电子定向移动,电解质溶液导电本质是靠溶液中的离子定向移动。
电解质溶液导电的特点是:(1)在电场作用下正、负离子向相反方向移动而导电,导电总量分别由正、负离子分担。(2)在导电过程中电极上发生化学反应。(3)温度升高,溶液电阻下降,导电能力增大。
问题三:用Pt电极电解一定浓度的CuSO4溶液,试分析阴极部、中部和阳极部溶液的颜色在电解过程中有何变化?若都改用Cu电极,三个部分溶液颜色变化又将如何?
回答:
Pt是惰性电极,电解时阴极部溶液中Cu2+被还原生成Cu,溶液中Cu2+的浓度变小,蓝色变淡;阳极部溶液中Cu2+向中间部迁移,Cu2+浓度降低,蓝色变淡,中部的颜色在短时间内基本保持不变。
用Cu做电极电解时,阴极部溶液中Cu2+的浓度变小,蓝色变淡,中部基本不变,阳极部的电极金属Cu被氧化成Cu2+ ,Cu2+浓度增加,蓝色变深。
问题四:法拉第电解定律的基本内容是什么?该定律在电化学中有何用处?
回答:
法拉第电解定律的基本内容是:通电于电解质溶液之后,(1)在电极上(两相面),发生化学变化的物质的量与通入电荷量成正比,(2)若将几个电解池串联,通入一定的电荷量后,在各个电解池的电极上发生化学变化的物质的量都相等。
法拉第电解定律数学表达式: ![]() 。式中
。式中![]() 是反应电荷数,
是反应电荷数,![]() 是反应进度,F是法拉第常数。
是反应进度,F是法拉第常数。
根据法拉第电解定律,通过分析电解过程中反应物在电板上物质的量的变化,就可求出电荷量的数值,或者,知道通过的电荷量计算出电解产物的数量,在电化学的定量研究和电解工业上有重要的应用。法拉第电解定律是电化学上最早定量的基本定律,不受温度、压力、地理环境、电解质浓度等影响。
问题五:在温度、浓度和电场梯度都相同的情况下,氯化氢、氯化钾、氯化钠三种溶液中,氯离子的运动速度是否相同?氯离子的迁移数是否相同?
回答:
因为温度、浓度和电场梯度都相同,所以三种溶液中氯离子的运动速度是相同的,但氯离子的迁移数不相同,因为迁移数是指离子迁移电量的分数,氢离子、钾离子、钠离子的运动速度不同,迁移电量的多少不同,所以相应的溶液中氯离子的迁移数也是不同的。
问题六:为什么正离子中的氢离子和负离子中的氢氧根离子的电迁移率的数值最大?
回答:
因为氢离子和氢氧根离子传递电荷的方式与其他离子不同,它们传导电荷时离子本身并没有迁移,而是依靠氢键断裂与生成以及水分子的翻转来传导电荷的,所以特别快,不过若在非水溶液中,氢离子和氢氧根离子就没有这个优势了。
问题七:为什么要提出离子迁移数概念?
回答:
某种离子迁移数表示该种离子所传递的电量占通过溶液总电量的分数。这一数值对研究电解过程、减少电化学测量中的液接电势等很有意义,因为迁移数的大小可以判断正负离子所输送的电量、电极附近浓度发生变化的情况等。
另外离子迁移数是可以测量的,因为某种离子迁移数也可看成该种离子的导电能力占电解质总导电能力的百分数,所以根据测得的迁移数,可以求出离子的极限摩尔电导率。
问题八:请说明离子迁移数与浓度、温度的关系如何?
回答:
(1)离子迁移数与浓度的关系:对正、负离子价态相同的溶液,浓度增大时,对正、负离子的迁移数影响基本相同;对正、负离子价态不同的溶液,浓度增大,对正、负离子的迁移数影响不同,价态高的离子迁移数减少比较明显
(2)离子的迁移数与温度的关系:温度升高,电解质电阻降低,离子迁移速率加快,对于只有一种电解质的溶液中,正、负离子迁移数趋于相等,都等于0.5。
问题九:“既然离子迁移数与离子的迁移速度成正比,那么当温度、浓度一定时,某离子的运动速度若为一定值,其迁移数也是一定的。”这个推论是否合理?
回答:
这个推论不合理。因为某种离子的迁移数不仅与它输送的电量多少有关,还与同溶液中其他离子输送的电量多少有关,例如Na+,虽然当温度、浓度一定时(如无限稀释时),它的运动速度为一定值,但与它相关联的负离子若改变,例如NaCl溶液改成NaAc溶液,它的迁移数就改变,不是一成不变的。另外对于有多种电解质的溶液,其他离子浓度等改变,输送的电量改变了,也对该离子的迁移数有影响,即迁移数不是定值。
问题十:电导率与摩尔电导概念有何不同?它们各与哪些因素有关?
回答:
电导率![]() 概念是:两极面积各为1 m2,并相距1 m时,其间溶液所呈的电导,也可以看成是1m3溶液的电导。摩尔电导
概念是:两极面积各为1 m2,并相距1 m时,其间溶液所呈的电导,也可以看成是1m3溶液的电导。摩尔电导![]() 概念是:在相距1 m的两电极间含有1 mol溶质的溶液所呈的电导,摩尔电导与电导率的关系为
概念是:在相距1 m的两电极间含有1 mol溶质的溶液所呈的电导,摩尔电导与电导率的关系为
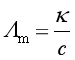
电导率![]() 与电解质本性有关,与温度有关,与电解质浓度有关;摩尔电导率
与电解质本性有关,与温度有关,与电解质浓度有关;摩尔电导率![]() 与电解质本性有关,与温度有关,与电解质浓度有关。
与电解质本性有关,与温度有关,与电解质浓度有关。
问题十一:在不同的电导池中对同一电解质溶液进行测量,所得的电导、电导率、摩尔电导率是否都相同?电导率和摩尔电导率在表示溶液导电能力方面有何不同?
回答:
不完全相同。用不同的电导池中对同一电解质溶液进行测量,测量出电导可能不同,但电导率与摩尔电导率并不因电导池变换而变化,因为不同的电导池的电阻是不同的,测量出电导当然不同,但同一电解质溶液的电导率、摩尔电导率是确定,并不因电导池不同而改变。
电导率是表示单位体积(1 m3)溶液的电导,摩尔电导率是在相距1 m的两电极间含1 mol电解质溶液的电导,电导率不能反映不同电解质溶液的导电能力,摩尔电导率可以反映相同价态不同电解质溶液的导电能力,对不同价态不同电解质溶液的导电能力不好比较,但若以基元单位电荷表示的摩尔电导率,就可以比较不同价态不同电解质溶液的导电能力。
问题十二:电解质溶液的导电能力与哪些因素有关?在表示溶液的导电能力方面,已经有了电导率的概念,为什么还要引入摩尔电导率的概念?
回答:
电解质溶液的导电能力与温度、电解质溶液中离子数目、一个离子荷电多少、离子迁移速率等因素有关。
因为电导率是单位截面积1 m的平行板电极,相距单位长度1 m溶液的电导,也可看成是体积1 m3溶液的电导,电导率不能客观地比较不同电解质溶液的电导能力的大小,因为1 m3电解质溶液含有的离子数多少可能不同,这样比较不合适,为了更合理的比较不同电解质溶液的导电能力,才要引入摩尔电导率,摩尔电导率是在相距为1 m的两个平行电极之间,放置含有1 mol电解质的溶液的电导,即1 mol溶质的电导率。然而1 mol电解质电离后,离子数可能不同,一个离子带电荷可能不同。例如1 mol HCI与1 molZnCl2,要真正合适(公平)比较电解质溶液的电导能力,应采用带电基元电荷的摩尔电导率来比较才比较合适。为了更公平比较不同电解质溶液导电能力才引入摩尔电导率的。
问题十三:为什么说用极限摩尔电导率来比较电解质溶液的导电能力更为合理?
回答:
因为极限摩尔电导率是指无限稀释时的基元电荷的摩尔电导率,在无限稀释时,所有电解质全部电离,离子之间的相互作用都可忽略,离子在电场的迁移速率只取决于该离子的本性,这样条件下比较电解质溶液的导电能力更为合理。
问题十四:电解质溶液的电导率随着电解质浓度的增加有什么变化?
回答:
电解质溶液分强电解质和弱电解质两种情况来讨论,电解质溶液的电导率是指两电极相距1 m、面积1 m2电极之间电解质溶液的电导,也可看成单位体积(1 m3)溶液的电导对于强电解质(如HCl、H2SO4、NaOH等),随着溶液浓度增加,参与导电的离子越多,则其电导率会随着浓度的增加而升高,但是,当浓度增加到一定程度后,由于正、负离子之间的距离减少,相互作用力增大,离子的迁移速率降低,所以电导率在达到一个最大值后,会随着浓度的升高反而下降,对于中性盐(如KCl等),由于受溶解度的限制,在到达饱和浓度之前,电导率随着浓度的增加而升高不会出现极大值。
对于弱电解质溶液,因为在一定温度下,由于弱电解质的解离常数是定值,当弱电解质的浓度增加时,电离度减少,电离出来的离子浓度基本保持不变,所以弱电解质溶液的电导率随浓度的变化不显著,一直处于比较低的状态。
问题十五:在水溶液中,带有相同电荷数的离子如Li+、Na+、K+等,其离子半径依次增大。离子半径越大,迁移速率应越小,离子的极限摩尔电导率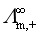 也应越小,因此,按这个道理它们离子极限摩尔电导率的顺次应为
也应越小,因此,按这个道理它们离子极限摩尔电导率的顺次应为 >
>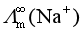 >
>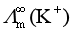 ,但实验得到的却是
,但实验得到的却是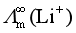 <
<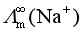 <
<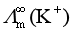 ,正好相反,这是为什么?
,正好相反,这是为什么?
回答:
其原因是离子水化作用,离于半径越小水化作用越强烈,离子水合的水分子越多,这样,Li+水合的水分子数>Na+水合的水分子数>K+水合的水分子数,在电场中,水合离子移动时要携带这些水合的水分子一起移动,这样造成Li+的迁移速率比Na+小,Na+又比K+迁移速率慢,离子极限摩尔电导率的顺次是:![]() <
<![]() <
<![]() 。
。

