一、 基本内容
电解质溶液属第二类导体,它之所以能导电,是因为其中含有能导电的阴、阳离子。若通电于电解质溶液,则溶液中的阳离子向阴极移动,阴离子向阳极移动;同时在电极/溶液的界面上必然发生氧化或还原作用,即阳极上发生氧化作用,阴极上发生还原作用。法拉第定律表明,电极上起作用的物质的量与通入的电量成正比。若通电于几个串联的电解池,则各个电解池的每个电极上起作用的物质的量相同。
电解质溶液的导电行为,可以用离子迁移速率、离子电迁移率(即淌度)、离子迁移数、电导、电导率、摩尔电导率和离子摩尔电导率等物理量来定量描述。在无限稀释的电解质溶液中,离子的移动遵循科尔劳乌施离子独立移动定律,该定律可用来求算无限稀释的电解质溶液的摩尔电导率。此外,在浓度极稀的强电解质溶液中,其摩尔电导率与浓度的平方根成线性关系,据此,可用外推法求算无限稀释时强电解质溶液的极限摩尔电导率。
为了描述电解质溶液偏离理想稀溶液的行为,以及解决溶液中单个离子的性质无法用实验测定的困难,引入了离子强度、离子平均活度、离子平均质量摩尔浓度和平均活度因子等概念。对稀溶液,活度因子的值可以用德拜-休克尔极限定律进行理论计算,活度因子的实验值可以用下一章中的电动势法测得。
二、 重点与难点
1.法拉第定律:![]() ,式中法拉第常量F=96485 C·mol-1。若欲从含有Mz+离子的溶液中沉积出M,则当通过的电量为Q时,可以沉积出的金属M的物质的量n为:
,式中法拉第常量F=96485 C·mol-1。若欲从含有Mz+离子的溶液中沉积出M,则当通过的电量为Q时,可以沉积出的金属M的物质的量n为: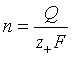 ,更多地将该式写作
,更多地将该式写作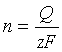 ,所沉积出的金属的质量为:
,所沉积出的金属的质量为: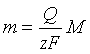 ,式中M为金属的摩尔质量。
,式中M为金属的摩尔质量。
2.离子B的迁移数: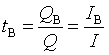 ,
,![]()
3.电导: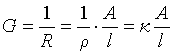 (k为电导率,单位:S·m-1)
(k为电导率,单位:S·m-1)
电导池常数: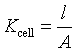
4.摩尔电导率: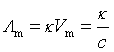 (c:电解质溶液的物质的量浓度, 单位:mol·m-3,
(c:电解质溶液的物质的量浓度, 单位:mol·m-3, ![]() 的单位:
的单位:![]() )
)
5.科尔劳乌施经验式:![]()
6.离子独立移动定律:在无限稀释的电解质![]() 溶液中,
溶液中,![]() ,式中,
,式中,![]() 、
、![]() 分别为阳离子、阴离子的化学计量数。
分别为阳离子、阴离子的化学计量数。
7.奥斯特瓦尔德稀释定律:设![]() 为弱电解质
为弱电解质![]() 浓度为c时的摩尔电导率,
浓度为c时的摩尔电导率,![]() 为该电解质的极限摩尔电导率,则该弱电解质的解离度为
为该电解质的极限摩尔电导率,则该弱电解质的解离度为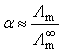
若弱电解质为1-1价型或2-2价型,则此时弱电解质化学式为![]() ,其解离平衡常数为:
,其解离平衡常数为: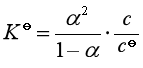
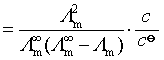
该式称为奥斯特瓦尔德稀释定律。
8.电解质![]() 的溶液中的离子平均质量摩尔浓度
的溶液中的离子平均质量摩尔浓度![]() 和离子平均活度因子
和离子平均活度因子![]() :
:
![]() ,
,![]()
式中,![]()
9.电解质![]() 的溶液中阴、阳离子的活度:
的溶液中阴、阳离子的活度:
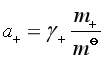 ,
,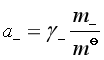
10.电解质B(![]() )的溶液的活度aB及离子平均活度
)的溶液的活度aB及离子平均活度![]() :
:
![]()
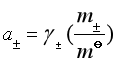
11.离子强度:![]()
12.德拜-休克尔极限公式:![]() (I<0.01mol·kg-1)
(I<0.01mol·kg-1)
![]() (I<0.01mol·kg-1)
(I<0.01mol·kg-1)

