第八章 可逆电池
 知识点三:电池电动势测定的应用
知识点三:电池电动势测定的应用
首先,归纳一下有关电动势的基本关系式,就可以了解关于电池电动势测定的某些重要的应用:
(1)![]() 。由标准电极电势表查得
。由标准电极电势表查得![]() 可计算
可计算![]() 。
。
(2)![]() 。由电池的电动势与热力学关系式可知,通过
。由电池的电动势与热力学关系式可知,通过![]()
![]() 及
及![]()
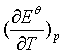 可计算
可计算![]() 、
、![]() 、
、![]() 及
及![]() 等。
等。
(3)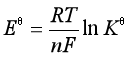 。由
。由![]() 可计算电池反应的平衡常数,微溶盐的溶度积、水的离子积、配合物的配合常数等。
可计算电池反应的平衡常数,微溶盐的溶度积、水的离子积、配合物的配合常数等。
(4)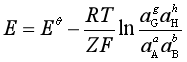 。在T一定时,由
。在T一定时,由![]() ,
,![]() q及浓度可求离子平均活度系数;由
q及浓度可求离子平均活度系数;由![]() 及其它物质的浓度求某种离子的活度,如H+的活度,或pH值;由浓度及活度系数计算
及其它物质的浓度求某种离子的活度,如H+的活度,或pH值;由浓度及活度系数计算![]() ,再根据
,再根据![]() 值正、负可判断反应进行的方向等。
值正、负可判断反应进行的方向等。
在考虑电池电动势测定的应用问题时,首先需要解决如何将涉及的过程设计成原电池的问题。
一、原电池的设计
将一过程设计成原电池,方法大体可归结为如下几点:
(1)将此物理化学过程分解成两部分,一部分发生氧化反应,一部分发生还原反应,其总的结果与该过程相同;
(2)将氧化反应部分作为负极,还原反应部分作为正极,从左到右,由负极极板开始按照实际顺序写出各个相,直到正极极板,对于第一类电极中的非金属电极和第三类电极,电极极板通常为Pt;
(3)当存在液相接界时一般要加上盐桥,用符号“||”表示,其余各相间则加上相界面符号“|”。
现举例如下:
例8 将氧化还原反应 Cu(s) + Cu2+(![]() 1) → 2Cu+ (
1) → 2Cu+ (![]() 2)设计成电池
2)设计成电池
解:负极 Cu (s) → Cu+ (![]() 2)+ e-
2)+ e-
正极 Cu2+ (![]() 1)+ e- → Cu+ (
1)+ e- → Cu+ (![]() 2)
2)
两电极反应之和即为该反应。因此可设计原电池为
Cu(s)|Cu+ (![]() 2)||Cu2+ (
2)||Cu2+ (![]() 1),Cu+ (
1),Cu+ (![]() 2)|Pt(s)
2)|Pt(s)
此电池要求两溶液中的Cu+ 活度相同。
另外,这一反应也可设计成其它二个电池。一个是
负极 Cu(s) → Cu2+(![]() 1) + 2e-
1) + 2e-
正极 2Cu2+ (![]() 1)+ 2e- → 2Cu+ (
1)+ 2e- → 2Cu+ (![]() 2)
2)
电池为Cu(s) |Cu2+(![]() 1) ||Cu2+ (
1) ||Cu2+ (![]() 1),Cu+ (
1),Cu+ (![]() 2)|Pt(s)
2)|Pt(s)
此电池也要求两溶液Cu2+的活度相同。
另一个: 负极 2Cu (s) → 2Cu+ (![]() 2)+ 2e-
2)+ 2e-
正极 Cu2+ (![]() 1)+ 2e- → Cu (s)
1)+ 2e- → Cu (s)
电池为 Cu(s)|Cu+ (![]() 2)||Cu2+ (
2)||Cu2+ (![]() 1)|Cu (s)
1)|Cu (s)
当这三个电池完成同样量的化学反应时,![]() 相同,可逆放电时,电功
相同,可逆放电时,电功 ![]() 应相同。但是三个电池输出的电量不同。取其中任意两个电池,根据
应相同。但是三个电池输出的电量不同。取其中任意两个电池,根据 ![]() =-
=-![]() q可得
q可得![]()
例9 将反应 H2(g, p)+![]() O2(g, p) → H2O(l)设计成原电池
O2(g, p) → H2O(l)设计成原电池
解:若将此反应设计为
负极 H2(g, p) → 2H+(![]() )+ 2e-
)+ 2e-
正极 ![]() O2(g, p)+ H2O (l)+ 2e- → 2OH-
O2(g, p)+ H2O (l)+ 2e- → 2OH-![]() )
)
则原电池为 Pt(s) |H2(g, p)| H+(![]() )|| OH-
)|| OH-![]() ) |O2(g, p)|Pt(s)
) |O2(g, p)|Pt(s)
然而这个电池反应为
H2(g, p)+ ![]() O2(g, p)+ H2O (l) → 2H+(
O2(g, p)+ H2O (l) → 2H+(![]() )+ 2OH-
)+ 2OH-![]() )
)
不符题意。生成的H+和OH-分别在两个溶液中,还不是水。因为只有左边![]() 与右边
与右边![]() 满足
满足![]()
![]() =
=![]() 时方能生成水。因此应按
时方能生成水。因此应按
负极 H2(g, p)+ 2OH-(![]() ) → 2H2O(l) + 2e-
) → 2H2O(l) + 2e-
正极 ![]() O2(g, p)+ H2O(l) + 2e- → 2OH-(
O2(g, p)+ H2O(l) + 2e- → 2OH-(![]() )
)
设计成电池 Pt (s) |H2(g, p)|OH- (![]() )|O2(g, p)|Pt (s)
)|O2(g, p)|Pt (s)
亦可按 负极 H2(g, p) → 2H+(![]() )+ 2e-
)+ 2e-
正极 ![]() O2(g, p)+ 2H+(
O2(g, p)+ 2H+(![]() )+ 2e- → H2O(l)
)+ 2e- → H2O(l)
设计电池为 Pt(s) |H2(g, p)|H+(![]() )|O2(g, p)|Pt(s)
)|O2(g, p)|Pt(s)
例10 在等温等压下进行中和反应为一自发过程,![]() <0,可作出非体积功,此非体积功可设计成电池在放电的过程中实现,试设计该原电池。
<0,可作出非体积功,此非体积功可设计成电池在放电的过程中实现,试设计该原电池。
解: 中和反应 H+(![]() )+ OH-(
)+ OH-(![]() ) → H2O (l)
) → H2O (l)
用氢电极 负极 ![]() H2(g, p)+ OH- (
H2(g, p)+ OH- (![]() ) → H2O(l) + e-
) → H2O(l) + e-
正极 H+(![]() )+ e- →
)+ e- → ![]() H2(g, p)
H2(g, p)
电池为 Pt(s) |H2(g, p)|OH- (![]() )||H+(
)||H+(![]() )|H2(g, p)|Pt(s)
)|H2(g, p)|Pt(s)
要求两电极的氢气压力相等。
还可以设计均用氧气作电极的电池
Pt (s) |O2(g, p)|OH- (![]() )||H+(
)||H+(![]() )|O2(g, p)|Pt(s)
)|O2(g, p)|Pt(s)
此时两电极的氧气压力要相等。
二、测定溶液的pH值
pH值的测定,在实际工作中是非常重要的。
由![]() 知,测定pH值实际上是确定
知,测定pH值实际上是确定![]() 的大小。用电动势测定溶液的pH值既准确又快捷。此法测定pH值的关键在于选择对氢离子可逆的电极。这类电极有:氢电极、醌氢醌电极、玻璃电极及锑电极等。
的大小。用电动势测定溶液的pH值既准确又快捷。此法测定pH值的关键在于选择对氢离子可逆的电极。这类电极有:氢电极、醌氢醌电极、玻璃电极及锑电极等。
1. 氢电极测pH值
将氢电极与甘汞电极组成如下的电池(298K)
Pt |H2(pq)|待测pH溶液 ||甘汞电极
![]() =
=![]() 甘汞-
甘汞-![]()
= ![]() 甘汞-
甘汞-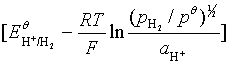
= ![]() 甘汞+
甘汞+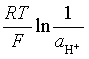
= ![]() 甘汞+
甘汞+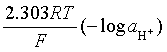
= ![]() 甘汞+0.05916pH
甘汞+0.05916pH
pH =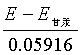
式中,25℃时,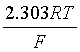 =(2.303×8.314×298.15/96487)V =0.05916V
=(2.303×8.314×298.15/96487)V =0.05916V
因此,测定该电池的电动势![]() ,就能求出待测溶液的pH值。氢电极对pH由0-14的溶液都可适用,但实际应用起来却有很多不便之处。例如,要求氢气很纯且要维持恒定压力,溶液中不能有氧化剂、还原剂或不饱和的有机物质,有些物质如蛋白质、胶体物质等易于吸附在铂电极上会使电极不灵敏、不稳定,因而产生误差。
,就能求出待测溶液的pH值。氢电极对pH由0-14的溶液都可适用,但实际应用起来却有很多不便之处。例如,要求氢气很纯且要维持恒定压力,溶液中不能有氧化剂、还原剂或不饱和的有机物质,有些物质如蛋白质、胶体物质等易于吸附在铂电极上会使电极不灵敏、不稳定,因而产生误差。
2. 玻璃电极测pH值
玻璃电极实际上是对氢离子具有特殊选择性的离子选择电极。它是在一支玻璃管下端焊接一个特殊原料的玻璃球形薄膜,球内盛一定pH值的缓冲溶液,或装有0.1mol·kg-1的HCl溶液和一支Ag-AgCl电极(称内参比电极)。将此玻璃电极插入待测溶液中,由于特制玻璃膜的两侧H+的活度不等而产生电势差,而玻璃膜内侧的H+浓度一定,即pH一定,则该玻璃电极的电势随外侧的H+浓度而变。298K时其电极电势为
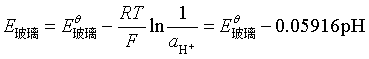
当玻璃电极与另一甘汞电极组成电池时,就能从测得的![]() 值求出溶液的pH值。
值求出溶液的pH值。
玻璃膜
Ag|AgCl(s)|HCl(0.1mol·kg-1)¦待测pH溶液|摩尔甘汞电极
在298K时,
![]() =
=![]()
移项经整理后得
pH=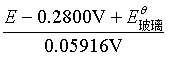
式中![]() 玻璃对给定的玻璃电极为一常数,但对于不同的玻璃电极,由于玻璃膜的组成不同,制备手续不同,以及使用后表面状态的不同,使得它们的
玻璃对给定的玻璃电极为一常数,但对于不同的玻璃电极,由于玻璃膜的组成不同,制备手续不同,以及使用后表面状态的不同,使得它们的![]() 值不尽相同。原则上用已知pH值的缓冲溶液,测出其
值不尽相同。原则上用已知pH值的缓冲溶液,测出其![]() 值,就能求出该电极的
值,就能求出该电极的![]() 值。
值。
因为玻璃膜电阻很大,一般可达10-100MΩ,这样大的内阻要求通过电池的电流必须很小。否则由于IR电位降就会产生不能忽略的误差。因此测量![]() 时不能用普通的电位差计,而要用电子管或晶体管伏特计。此种配有玻璃电极专门用来测量溶液pH值的仪器叫做pH计。实际使用时,是先用已知其pH值的溶液,在pH计上进行调整使
时不能用普通的电位差计,而要用电子管或晶体管伏特计。此种配有玻璃电极专门用来测量溶液pH值的仪器叫做pH计。实际使用时,是先用已知其pH值的溶液,在pH计上进行调整使![]() 和pH的关系能满足上述关系式,然后再来测定未知液pH值,而不需要算出
和pH的关系能满足上述关系式,然后再来测定未知液pH值,而不需要算出![]()
![]() 的具体数值。
的具体数值。
pH未知 = pH标准 + 
由于玻璃电极不受溶液中存在的氧化剂、还原剂的干扰,也不受各种杂质的影响,使用方便,故应用广泛。
玻璃电极是一种对H+具有选择性的电极,有一种玻璃电极膜的组成是72%SiO2,22%Na2O和6%CaO,用其制成的玻璃电极可用于pH为1-9的范围,如改变组成,其使用范围可达pH=1-14。此外,改进被测的成分还可制成分别对Na+、K+、![]() 、Ag+、Tl+、Rb+、Cs+ 等一系列阳离子的选择电极。应用Ag2S压片,还可制成S2-离子选择的膜电极。
、Ag+、Tl+、Rb+、Cs+ 等一系列阳离子的选择电极。应用Ag2S压片,还可制成S2-离子选择的膜电极。
3. 醌氢醌电极测pH值
![]() 通常醌氢醌电极放入待测溶液中与0.1mol·dm-3KCl甘汞电极组成原电池,测定其电动势
通常醌氢醌电极放入待测溶液中与0.1mol·dm-3KCl甘汞电极组成原电池,测定其电动势![]() ,从而计算出待测溶液的pH值。298K时,
,从而计算出待测溶液的pH值。298K时,![]() =(0.6993-0.05916pH)V,
=(0.6993-0.05916pH)V,![]() =0.2799V。当待测溶液的pH=7.09时,醌氢醌电极与甘汞电极的电极电势相等。因此,当待测溶液pH﹤7.09时,醌氢醌电极应为正极,甘汞电极作负极,待测溶液的
=0.2799V。当待测溶液的pH=7.09时,醌氢醌电极与甘汞电极的电极电势相等。因此,当待测溶液pH﹤7.09时,醌氢醌电极应为正极,甘汞电极作负极,待测溶液的
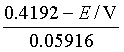
醌氢醌电极的制备和使用都极为方便,且不易中毒。但它不能用于碱性溶液中,当pH﹥8.5时,将由于大量氢醌分子的酸式解离,而使得![]() 的假定不能成立。这样在计算待测溶液的pH值时就会产生误差。此外,在碱性溶液中氢醌容易氧化,也会影响测定的结果。
的假定不能成立。这样在计算待测溶液的pH值时就会产生误差。此外,在碱性溶液中氢醌容易氧化,也会影响测定的结果。
很多氧化还原反应的电极电势不仅与溶液中离子的浓度有关,而且与溶液的pH值有关,如果指定浓度,则电极电势仅与pH有关。因此可以把一些有H+或OH-参加反应的电极电势与pH的关系绘成图,即由一些等温等浓度的电极电势-pH线汇成的图,称为电势-pH图。由电势-pH图可以直接判断在一定的pH范围内,哪一种电极反应将优先进行。电势-pH图最早用于研究金属腐蚀问题,极有成效,随后在电化学、无机、分析、湿法冶金和地质科学等方面都有广泛的应用。由于篇幅所限,本教材对电势-pH图及其应用不作详细介绍,读者可查阅相关著作或资料。
三、求难溶盐的活度积
活度积有时也称为溶度积,用![]() 表示,它也是一种平衡常数。是量纲一的量。这里以求AgI的
表示,它也是一种平衡常数。是量纲一的量。这里以求AgI的![]() 为例,说明如何由
为例,说明如何由![]() 值计算
值计算![]() 。
。
将溶解平衡反应 AgI(s)= Ag+(![]() Ag+)+I-(
Ag+)+I-(![]() I-)设计成原电池,
I-)设计成原电池,
Ag(s)︱Ag+(![]() Ag+)‖I-(
Ag+)‖I-(![]() I-)︱AgI(s) |Ag(s)
I-)︱AgI(s) |Ag(s)
负极:Ag(s) → Ag+(![]() Ag+)+e-
Ag+)+e-
正极:AgI(s) +e- → Ag(s)+ I-(![]() I-)
I-)
电池反应:AgI(s) → Ag+(![]() Ag+) +I-(
Ag+) +I-(![]() I-)
I-)
查标准电极电势表得 ![]() q=
q=![]() =(-0.151-0.7991)V=-0.9501V
=(-0.151-0.7991)V=-0.9501V
在298K时,
![]() ln
ln![]() =
=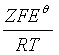 =
=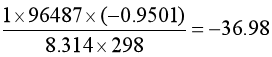
![]() =8.705
=8.705![]() 10-17
10-17
所设计电池的![]() q为负值,是非自发电池,但这无关紧要,因为是通过计算而非实测来求
q为负值,是非自发电池,但这无关紧要,因为是通过计算而非实测来求![]() 的。如果将正、负极对调,就成为自发电池。这时电池反应的
的。如果将正、负极对调,就成为自发电池。这时电池反应的![]() =1/
=1/ ![]() 。
。
上面设计电池的正极所含I-离子的溶液中,实际上已为AgI(s)所饱和,若把电极反应写成
负极: Ag(s) → Ag+(![]() Ag+)+e-
Ag+)+e-
正极: Ag+(![]() )+e- → Ag(s)
)+e- → Ag(s)
电池反应: Ag+(![]() ) → Ag+(
) → Ag+(![]() Ag+)
Ag+)
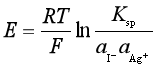
只要测出电动势![]() ,就可求得
,就可求得![]() (
(![]() 的数值根据所配制的AgI溶液的浓度和
的数值根据所配制的AgI溶液的浓度和![]() 值可以计算得到)。显然两种方法得到的
值可以计算得到)。显然两种方法得到的![]() 是一样的。
是一样的。
用类似的方法还可以求弱酸(或弱碱)的离解常数、水的离子积常数和配合物不稳定常数等。
四、电解质的离子平均活度系数测定
以氢电极和甘汞电极构成的单液电池为例,可求出不同浓度HCl溶液的![]() 。
。
Pt(s) |H2(pq)|HCl(![]() )|Hg2Cl2(s) |Hg(l)︱Pt(s)
)|Hg2Cl2(s) |Hg(l)︱Pt(s)
负极: 1/2 H2(pq) → H+(![]() )+e-
)+e-
正极:1/2 Hg2Cl2(s)+ e- → Hg+Cl-(![]() )
)
电池反应: 1/2 H2(pq) + 1/2 Hg2Cl2(s) → Hg(l)+ HCl(![]() )
)
电池的电动势 ![]() =(
=(![]() )-
)-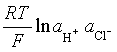
对于1-1价型电解质, ![]() + =
+ = ![]() - =
- = ![]() ,故
,故
![]() =
=![]()
![]()
![]() .
.![]()
![]() =(
=(![]()
![]() )2
)2
代入![]() 的计算式得
的计算式得
![]() =
=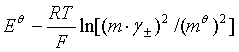
=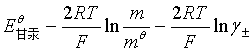
只要查得![]() 和测得不同浓度HCl溶液的电动势
和测得不同浓度HCl溶液的电动势![]() 就可求出不同浓度时的
就可求出不同浓度时的![]() 值。
值。
例11 电池 Pt(s) |H2(pq)|HCl(![]() )|Hg2Cl2|Hg(l)︱Pt(s)
)|Hg2Cl2|Hg(l)︱Pt(s)
已知![]() =0.07503mol·kg-1,在298K下测得
=0.07503mol·kg-1,在298K下测得![]() =0.4119V,求该浓度HCl的
=0.4119V,求该浓度HCl的![]() 。
。
解 查表得![]() =0.2676V
=0.2676V
所以 0.4119V=[0.2676-2×0.05916(log0.07503+log![]() )]V
)]V
解得 ![]() =0.804
=0.804
另外,如果活度系数可以根据德拜-休克尔公式计算,则可用上述方法求![]() 值。以下列电池为例
值。以下列电池为例
Pt(s) |H2(pq)|HCl(![]() )|AgCl(s)-Ag(s)
)|AgCl(s)-Ag(s)
假定![]() 为未知,则不难推得
为未知,则不难推得
![]() =
=![]() +
+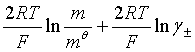
对于1-1价型电解质,![]() ,
,![]() =1,则德拜-休克尔公式为
=1,则德拜-休克尔公式为
ln![]() =
=![]() |
|![]() |
|![]()
![]()
于是 ![]() =
=![]() +
+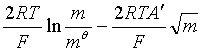
设上式右边诸项之和为![]() ,以
,以![]() 对
对![]() 或
或![]() 作图,在稀溶液的范围内可近似得一直线,外推到
作图,在稀溶液的范围内可近似得一直线,外推到![]() →0时,这时
→0时,这时![]() (
(![]() →0)=
→0)=![]() 。
。
