本章用化学热力学的观点讨论电极反应的可逆行为。原电池是将化学能转变为电能的装置,两个电极和电解质溶液是电池最重要的组成部分。电极电势是本章主要概念之一,它是把一个电极与标准氢电极(作为负极)组成一个已消除了液接电势的原电池,其电动势就是给定电极的标准电极电势。对于一个可逆化学电池,正负极间的电势差称电池的电动势,可用电池反应的能斯特方程计算。因为电池电动势与热力学量之间密切相关,所以本章内容是以电动势为主线而展开的。
一、 基本内容
(一) ![]() =-zFE
=-zFE
式中![]() 为电池反应的摩尔吉布斯自由能变;z是电池反应的电子的物质的量;E为电池的电动势。此式适用于等温等压的可逆过程,所以E为可逆电池的电动势。此式表明,在可逆电池中,化学反应的化学能(
为电池反应的摩尔吉布斯自由能变;z是电池反应的电子的物质的量;E为电池的电动势。此式适用于等温等压的可逆过程,所以E为可逆电池的电动势。此式表明,在可逆电池中,化学反应的化学能(![]() )全部转变成了电能zFE。该式将化学反应的性质与电池的性质联系起来,是电化学的基本公式之一。若参与电池反应的所有物质均处于各自的标准态,则上式成为
)全部转变成了电能zFE。该式将化学反应的性质与电池的性质联系起来,是电化学的基本公式之一。若参与电池反应的所有物质均处于各自的标准态,则上式成为
![]() =-zF
=-zF![]()
其中![]() 称为电池的标准电动势,对于指定的电池,
称为电池的标准电动势,对于指定的电池,![]() 只是温度的函数。
只是温度的函数。
(二) 电池反应的能斯特公式
若电池反应为 aA+bB![]() gG+hH
gG+hH
E=![]() -
-![]() ㏑
㏑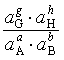
此式表明,电池的电动势取决于参加反应的各物质的状态,它对如何改变电池电动势具有指导意义,计算时首先要正确写出电池反应式。
(三) 电极反应的能斯特公式
若电极反应为 aA+bB+ze-![]() gG+hH
gG+hH
E电极=![]() -
-![]() ㏑
㏑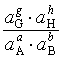
式中E电极和![]() 分别为该电极的电极电势和标准电极电势。此式表明,一个电极的电势取决于参与电极反应的各物质的状态。计算的关键是要正确写出电极反应。
分别为该电极的电极电势和标准电极电势。此式表明,一个电极的电势取决于参与电极反应的各物质的状态。计算的关键是要正确写出电极反应。
(四) E=![]() ,
,![]() =
=![]()
式中E和![]() 分别为可逆电池的电动势和标准电动势;
分别为可逆电池的电动势和标准电动势;![]() (
(![]() )和
)和![]() (
(![]() )分别为正极和负极的电极电势(标准电极电势)。
)分别为正极和负极的电极电势(标准电极电势)。
(五) 标准电动势![]() 与标准平衡常数
与标准平衡常数![]() 的关系
的关系
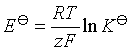
(六) 电池反应的熵变![]() 与电池电动势的温度系数的关系
与电池电动势的温度系数的关系
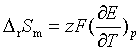
(七) 电池反应的焓变![]() 与电池电动势E和电池电动势的温度系数的关系
与电池电动势E和电池电动势的温度系数的关系
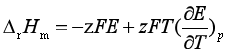
(八) 可逆电池的反应热效应QR与电池电动势的温度系数的关系
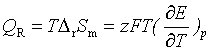
二、 重点与难点
1、电化学主要研究电能和化学能之间的相互转化及转化过程中的有关规律。必须将电池表示式与电池反应“互译”,即将化学反应与电池相关联,尤其是将已知化学反应设计成电池表示式,读者往往难以入手。
2、可逆电池热力学。可逆电池必须满足两个条件:一是电池反应可逆,另一是充电放电能量可逆。电池电动势是组成电池的各相界面上可能存在的电势差的代数和,用热力学可推导出电池电动势的能斯特方程,它表明电动势除与物质的本性有关外,还与温度及离子的活度有关。电池电动势与热力学函数的关系是必须掌握的重点内容之一。
3、电极电势的定义,参比电极、电极电势与温度和活度的关系等,尤其是对标准氢电极更要深入了解。
4、电动势测定的主要应用:判断电池反应方向、测定溶液的pH值、求难溶盐的活度积、测定电解质离子的平均活度系数等。这里涉及的计算较多,需熟练运用有关概念和基础知识。

