当前位置:课程学习>>第九章 不可逆电极过程>>知识讲解>>视频课堂>>知识点四
知识点四:化学电源
二、电池的氧化还原化学
为什么电池的负极常选择Zn、Cd、Pb等,而正极常选择MnO2、Ag2O、HgO这些氧化物?
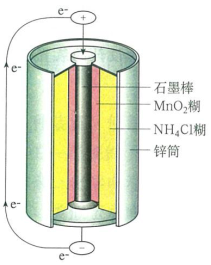
碱性锌锰电池:(-)Zn|KOH(aq)|MnO2,C(石墨)(+)
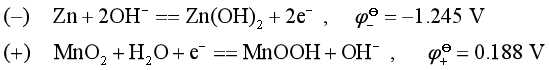
在碱性溶液中,OH-被氧化和H2O被还原的电极反应分别为:
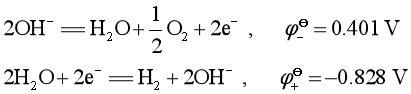
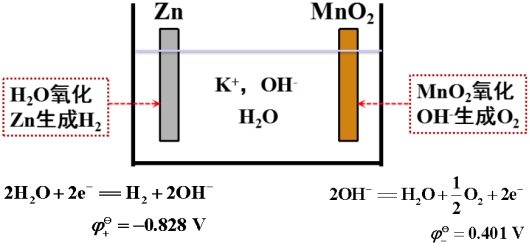
因此,比0.401 V大的正极物质可以氧化OH-,即发生自放电。所以正极最好选择靠近0.401 V的物质,这就是为什么选择MnO2、Ag2O、HgO作为正极物质的原因。
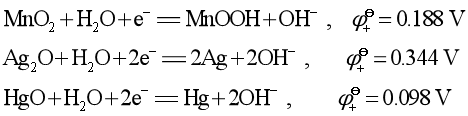
同理,比-0.828 V更小的负极物质可被H2O氧化。Zn(-1.245 V)作为负极是由于高纯锌是难于析氢的金属(ηH2= 0.7 V),使用时把Hg刷在锌表面(汞齐化)。
电池采用碱液是为了使氧化物不溶解。
又如,铅酸蓄电池:
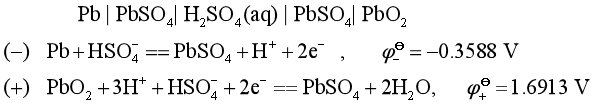
总反应为:
![]()
在酸性溶液中,H2O被氧化和H+被还原的电极反应分别为:
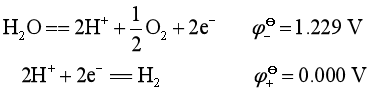
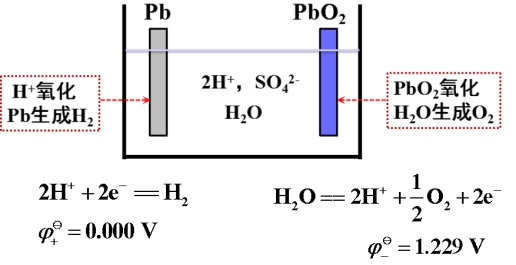
在酸性溶液中,PbO2氧化H2O析出O2困难!Pb置换H+析出H2困难!
铅蓄电池就是把析氧超电势大的PbO2与析氢超电势大的Pb组合起来,从而确保了电极的稳定性,其电动势E =2.05 V。这在水溶液系统电池中是极佳的组合,铅蓄电池已有百余年(1859年)的历史,而今仍占据二次电池的主导地位,其原因就在于此。
接下来让我们进行下一部分的学习
