本章从化学动力学的角度讨论电极反应的不可逆行为。当有电流通过电极时,其电极电势偏离可逆电极电势的现象称为极化。某一电流密度下极化电极电势与可逆电极电势间的差值为此时该电极的超电势,超电势的数值随着电流密度的增加而增加。极化主要有浓差极化和电化学极化。
无论是原电池还是电解池,在阴极上,由于超电势的存在使析出电势变小;在阳极上超电势则使析出电势变大。由此可见超电势存在的不利一面,即对电解池,在电解过程中由于超电势的存在使外加电压增加而多消耗电能;对原电池,超电势则使电池电动势变小而降低了对外作功的能力。但我们同时也看到超电势存在的有利一面,即在水溶液中进行的电解或电镀过程中,在阴极上可以析出Zn、Ni、Sn、Cr等比氢活泼的金属,这也是极谱分析的原理所在。H2在阴极上的超电势可用塔菲尔公式计算。
在实际电解时,在阴极上优先发生还原反应的是析出电势最大者,在阳极上优先发生氧化反应的是析出电势最小者,据此我们可以判断电解时电极上发生的电极反应、析出物质的先后顺序、共存金属离子同时析出形成合金的条件以及判断两种共存金属离子能否得到有效分离。
电镀、金属精炼、金属的防腐、化学电源和有机电合成等是电化学中具有极其重要的实际应用价值的领域。
一、 基本内容
(一) 分解电压计算公式
E分解 = E可逆 +△E不可逆 + IR
= E可逆 + η阳+η阴+IR
分解电压是使电解过程持续稳定进行所必须施加的最小外加电压,它随电极材料、电解液、温度等条件不同而异。
(二) 超电势计算公式
η阴=E阴,可逆-E阴,析出
η阳=E阳,析出-E阳,可逆
超电势总为正值,它是对电极极化的一种度量,根据产生超电势的原因不同,可将超电势分为电化学超电势、浓差超电势、欧姆超电势等。对于一个指定的电极,超电势随电流密度的增大而增大。
(三) 浓差超电势η浓差
若电极反应为![]() +ze-
+ze-![]() M,假设产物M生成独立相,溶液中有大量支持电解质且没有对流,则
M,假设产物M生成独立相,溶液中有大量支持电解质且没有对流,则
η浓差=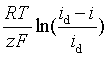
式中i为电极上通过的电流,id为极限扩散电流。
(四) 离子的析出电势
E阳,析出= E阳,可逆 + η阳
E阴,析出= E阴,可逆-η阴
(五) 塔菲尔公式
η=a+bln(j/[j])
式中a、b是常数,其数值由电极反应的种类、电极材料及其表面状态、温度等因素决定。对于一些常见的电极反应,该式表示电极的超电势η是随电流密度的对数线性地增加。
二、 重点与难点
1. 极化和超电势
电流通过电极时,电极电势偏离可逆电极电势的现象称为极化。极化主要分为浓差极化和电化学极化。
超电势是某一电流密度下,极化程度的量度,若不标明电流密度,则超电势的含义是不明确的。
2. 氢超电势理论
常见的有迟缓放电理论、复合理论和电化学脱附理论。氢在各种金属上析出的电化学超电势服从塔菲尔公式,当电流密度很小时,该公式并不适用。在许多情况下,塔菲尔公式也适用于其他气体电极反应,只是经验常数不同而已。
3. 析出电势的应用
在极化情况下,判断离子的析出顺序、讨论分离效果、金属的阳极溶解和防止氢气析出、控制溶液的pH等,这里涉及的计算较多,需熟练运用有关概念和知识。
4. 在电解、电镀和电化学防腐方面的应用
结合计算从理论上解释不可逆电极过程。

