同学们,本栏目是对你们学过的知识和生活中常见问题的归纳。其中,有一些共性问题,也许你会需要哦!
让我来帮你解决常见问题!
问题一:何谓分解电压和理论分解电压?二者在数值上有何差别?
回答:
电压是指对电解质溶液进行实际电解时,电解质溶液开始显著发生电解时所必需的外加最小电压,理论分解电压是在可逆条件下进行电解时外加的电压,其数值等于电解产物构成的电可逆池的反向电动势,例如用Pt电极电解H2SO4溶液的理论分解电压是1. 229 V,实际分解电压是1.69 V,二者在数值上是不同的,实际分解电压大于理论分解电压。
问题二:为什么实际分解电压总要比理论分解电压大一些?
回答:
实际分解电压要克服以下阻力:(1)电解产物与电极组成的原电池的可逆电动势,该数值通常称为理论分解电压,其值用ER表示;(2)由于两个电极上发生极化而产生的超电势![]() 和
和![]() ,通常称为不可逆电动势。所以实际分解电压为:
,通常称为不可逆电动势。所以实际分解电压为:![]() ,这样,实际分解电压一定大于理论分解电压。
,这样,实际分解电压一定大于理论分解电压。
问题三:什么是极化作用?什么叫超电势?两者关系如何?电极极化分为哪几种?极化作用带来哪些结果?
回答:
极化作用是电极上有(净)电流通过时,电极电势偏离平衡电极电势的现象称为电极的极化。超电势是指某一电流密度下的电极电势与其平衡电极电势之差的绝对值称为超电势。两者关系:因为有极化作用才产生过电势,没有极化作用就没有过电势。
电极极化的分为浓差极化、电化学极化、电阻极化三种。
电极极化的结果使电极电势偏离可逆时(平衡态)电极电势,使电解池电解外加电压大于理论分解电压,使原电池输出电压小于电池电动势。
问题四:原电池和电解池的极化现象有什么不同?说明放电和充电过程的阳极、阴极、正极和负极的各自极化情况,能否归纳出一些共同的规律?
回答:
原电池发生极化,负极电势升高,正极电势降低,正负电极的之间的电势差减小,即输出电压降低,小于电池电动势,电解池极化,阳极电势升高,阴极电势降低,加在电解池的外电压增加,由于原电池的正极发生的还原反应,也可称为阴极,负极发生的氧化反应,也可称阳极,这样电极极化的共同规律:无论是原电池还是电解池,发生极化时,都是阳极电势升高,阴极电势降低。
问题五:为什么说只要是在不可逆情况下,不论电化学反应的方向如何,阴极极化的电极电势总是向负(减小)的方向移动,而阳极极化的电极电势总是向正(增加)的方向移动?
回答:
因为在不可逆情况下即电极极化时,阴极上还原反应的活化能增加,反应速率比未发生极化时减慢,或参加反应的阳离于浓度降低,M+ +e-=M(s),流到阴极的负电荷来不及消耗掉,造成阴极的负电荷积聚,使电极电势降低(向负方向移动);而阳极极化时,阳极上氧化反应的活化能降低,反应速率比未极化时加快,M-e-=M+,或参加反应的阳离子来不及迁移出去,造成阳极的正电荷积聚,使电极电势升高(向正方向移动),这些原因造成发生极化时,都是阳极电势升高,阴极电势降低。
问题六:在测定极化曲线时,为什么要使用一个参考电极?对参考电极应该有什么要求?
回答:
因为使用一个参考电极的目的是采用对消法,测量出待测电极(研究电极)在有电流通过时的电极电势,测定方法:先测出无电流通过时待测电极与参比电极组成电池的平衡电动势,由于参比电极的电极电势是已知的,可得出平衡条件下待测电极的电极电势:再测量有电流通过待测电极时,待测电极与参比电极组成电池的非平衡态下的电池电动势,得出非平衡态下待测电极的电极电势,不断改变外加电流,可以测量出不同电流密度时待测电极的电极电势,绘制出电极极化曲线。
对参考电极要求:电极电势稳定,数值已知,可逆性大,例如饱和甘汞电极。
问题七:什么叫超电势?它是怎样产生的?如何降低超电势的数值?
回答:
把某一电流密度下的电极电势![]() 与可逆条件下电极电势
与可逆条件下电极电势![]() 之间的差值称为超电势。超电势是由于电极的极化而产生的,是电极极化程度的一种量度。超电势产生的原因有:由于发生电化学极化、浓差极化和电阻极化作用时产生的。
之间的差值称为超电势。超电势是由于电极的极化而产生的,是电极极化程度的一种量度。超电势产生的原因有:由于发生电化学极化、浓差极化和电阻极化作用时产生的。
降低电化学极化产生的超电势方法,可采用改变电极材料、改变电极表面状态、降低极化电流、改变溶液组成、选择催化剂、加入去极化剂等来降低超电势的数值;降低浓差极化产生超电势的方法,可以采用升高温度、加强电极附近搅拌、使用旋转电极等方法来降低超电势的数值;降低电阻极化产生超电势的方法,可采用改变电极材料、改变溶液组成等方法来降低超电势的数值。
问题八:电化学中为什么常用电流密度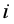 表示电极反应速率?
表示电极反应速率?
回答:
于电流密度![]() 与电极表面反应速率
与电极表面反应速率![]() (单位时间单位电极表面上产物的增加量)之间的关系为
(单位时间单位电极表面上产物的增加量)之间的关系为![]() ,成正比例关系,电极表面反应速率大,则电流密度就大,并且电流密度容易测量,所以电化学中常用电流密度表示电极反应速率更为便捷。
,成正比例关系,电极表面反应速率大,则电流密度就大,并且电流密度容易测量,所以电化学中常用电流密度表示电极反应速率更为便捷。
问题九:试比较电化学极化和浓差极化的基本特征。
回答:
电化学极化是由于电极表面进行化学反应或电化学反应不可逆过程而引起的,电化学极化的大小决定于电极表面反应的活化能,而这活化能大小又随电极上的外加电压大小而改变。浓差极化是由于参加电极反应的物质在界面附近和溶液本体存在着浓度差引起不可逆扩散过程而造成的极化,加强搅拌,减小扩散层厚度,可以降低浓羞极化。
问题十:什么叫氢超电势?影响氢超电势的因素有哪些?氢超电势的存在对电解过程有何利弊?
回答:
氢超电势是指氢气在作为阴极的各种电极材料上析出电势与它的可逆电极电势之间的差值称为氢超电势。
它与电极材料、溶液组成、电流密度和温度等因素有关,在铂、钯等贵金属材料上氢超电势最小,其次为铁、镍、钴、铜、银、钨等,而在锡、锌、镉、汞、铅等金属上氢超电势最大,相同电极材料上,电流密度越大,氢超电势越大,塔菲尔总结出经验公式,表示氢超电势与电流密度的定量关系![]() ,
,![]() 是电流密度。
是电流密度。
氢超电势的存在不利的地方:用电解水方法制备H2,由于氢超电势的存在,使得电解时外加电压增大,需要消耗更多能量,电流效率降低。有利的地方:某些生产过程,如湿法冶金、电解、电镀时,应用对氢高有超电势的金属作阴极可以抑制产生氢气的副反应,利用氢高超电势,使得金属元素活动顺序表中在H之前的金属离子也能顺利地在阴极还原出来。
问题十一:离子析出电势与离子平衡电势有何不同?由于超电势的存在,使电解池阴、阳极上的析出电势如何变化?超电势的存在有何不利和有利之处?
回答:
电解时离子在电极放电时电极电势称为离子析出电势,它是不可逆电势。离子析出电势与离子平衡电势的关系:
![]()
一定电流密度下,每个电极的实际析出电势等于可逆电势加上或减去其超电势。
超电势使得电解池的阴阳两极随电流密度的增大,阳极更正,阴极更负,外加电压增大,消耗电能增多,从能量消耗上讲,超电势的存在都是不利的。但超电势也可以利用,例如,由于氢超电势存在,电解时可以使得金属元素活动顺序表中在H之前的金属离子在阴极析出而不放出氢气,再如极谱分析,就是利用浓差极化(浓差超电势)来分析的一种方法。
问题十二:在电解时,正、负离子分别在阴、阳电极上放电,其放电先后次序有何规律?
回答:
电解时,在阴极上发生还原反应,当电极电势逐渐降低时,各离子按析出电势由高到低顺序先后放电,在阳极上发生氧化反应,当阳极电势逐渐升高时,各离子按析出电势由低到高顺序先后放电。
问题十三:电解HCl或NaCl水溶液时,阳极上析出O2还是Cl2?为什么?
回答:
看用什么电极才能确定电解产物,若用Pt电极,则阳极上析出O2,因为O2在Pt上的超电势很小可以忽略,而O2的析出电势(近似为可逆电势)小于Cl2的析出电势,因此O2首先在阳极上放电,若用Pb、Zn、石墨等作电极,阳极上析出Cl2,因为O2在Pb、Zn、石墨等上的超电势较大,而Cl2在Pb、Zn、石墨等作电极上超电势较小,使O2的析出电势大于Cl2的析出电势,所以电解时Cl2首先在阳极上放电。
问题十四:试说明化学腐蚀和电化学腐蚀的有什么不同的特征?
回答:
化学腐蚀特征是:在金属表面直接发生化学反应使金属氧化、溶解,即氧化成离子或高价化合物,从而使金属破坏的腐蚀。电化学腐蚀的特征是:主要发生在非均匀的金属表面上,在金属表面构成腐蚀电池(局部电池),产生的腐蚀电流,发生电化学反应,使金氧化、溶解,从而使金属破坏的腐蚀。化学腐蚀和电化学腐蚀的不同的特征是,化学腐蚀发生时没有构成腐蚀电池,不产生的腐蚀电流,电化学腐蚀发生时构成腐蚀电池,产生的腐蚀电流,电化学腐蚀比化学腐蚀速率快,危害性更大,例如金属锌在稀H2SO4中发生的是化学腐蚀,而含Cu、Fe杂质的锌在空气、水中除发生化学腐蚀外,还要发生电化学腐蚀,比在稀H2SO4中锌腐蚀速率更快。
问题十五:试就影响热机效率和燃料电池理论效率的因素进行比较,为什么可以说“燃料电池的能量转换效率不受卡诺循环限制”?
回答:
目前一般的热电厂,是把燃料(煤、油等)燃烧获得热能,然后再利用热机把热能转换机械能,机械能再带动发电机变成电能,由于热机的效率(受卡诺循环限制)比较低燃料的利用率很低,一般效率不到20%。
而燃料电池是一种把燃料和氧化剂储存在电池的外部,以后可以连续加入,产物则随时排出,可以连续工作、能把燃料燃烧氧化的化学能直接转化为电能的电化学装置,由于燃料电池把化学能直接变成电能,因此不受卡诺循环限制,燃料利用率比较高。

