第九章 不可逆电极过程
 知识点四:化学电源
知识点四:化学电源
化学电源是将物质的氧化还原反应产生的能量直接转换成电能的装置。即它是一种贮存化学能的装置并且需要时就可将化学能立即转变成电能进入外电路。因此它具有作为独立电源的功能,是实用的原电池。
化学电源对人类现代生活的重要性不言而喻。随着科学技术的迅速发展,对化学电源的要求也越来越高。例如,集成电路的发展,要求化学电源必须小型化;电子器械、医疗器械和家用电器的普及,不仅要求其体积小,而且还要求能量密度高、贮存性能好、电压精度高;航天技术的发展也大大促进了化学电源的发展。
一、化学电源的重要参数
化学电源的电能是由电池中自发的化学变化产生。氧化剂和还原剂不是直接进行反应,而是在电池的正、负极被消耗,产生的电子从电池两终端之间的外电路通过。实际上,人们总是为特定的功用设计制造电池,例如手电筒、心脏起搏器和汽车发动机等所需电池的性能和技术参数是不同的。电池的性能除了与电极反应的选择和电极过程的动力学有关外,还取决于电池的几何形状、电池的设计和组成成分。电池的主要成分有正极活性物质、负极活性物质、正极集电器、负极集电器、集电端、隔膜、电解质和容器等等。
化学电源的性能通常用电池容量、电池能量密度(比能量)和电池功率密度(比功率)等几个重要参数来衡量。电池容量是指电池所能输出的电量,一般以![]() 为单位,用符号
为单位,用符号![]() 表示;电池能量密度是指电池输出的电能与电池的质量或体积之比,分别称为质量能量密度或体积能量密度,单位分别用
表示;电池能量密度是指电池输出的电能与电池的质量或体积之比,分别称为质量能量密度或体积能量密度,单位分别用![]() 和
和![]() 表示。理论能量密度是指每千克参与反应的活性物质所提供的能量。由于电池有极板架、外壳等附加质量,即所含活性物质不可能全部参与反应,所以实际的能量密度要比理论能量密度小得多。单位重量或单位体积的电池输出的功率称为功率密度,单位分别为
表示。理论能量密度是指每千克参与反应的活性物质所提供的能量。由于电池有极板架、外壳等附加质量,即所含活性物质不可能全部参与反应,所以实际的能量密度要比理论能量密度小得多。单位重量或单位体积的电池输出的功率称为功率密度,单位分别为![]() 和
和![]() 。功率密度的大小表征电池所能承受的工作电流的大小。
。功率密度的大小表征电池所能承受的工作电流的大小。
电池的开路电压与工作电压也是化学电源的重要性能指标。电池的开路电压是指外线路中无电流通过时,电池两极间的电势差,用符号![]() 表示。
表示。![]() 一般均小于其电动势。因为电池的两极在电解质溶液中所建立的电极电势,通常不是可逆电极电势,只有当电池的两极体系均达到热力学平衡态时,
一般均小于其电动势。因为电池的两极在电解质溶液中所建立的电极电势,通常不是可逆电极电势,只有当电池的两极体系均达到热力学平衡态时,![]() 才等于电池的电动势。电池的工作电压是指有电流通过外线路时,电池两极之间的电势差。当电流通过电池内部时,必须克服由电极极化和欧姆内阻所造成的阻力。因此,工作电压总是低于
才等于电池的电动势。电池的工作电压是指有电流通过外线路时,电池两极之间的电势差。当电流通过电池内部时,必须克服由电极极化和欧姆内阻所造成的阻力。因此,工作电压总是低于![]() ,当然也必定低于电动势。
,当然也必定低于电动势。
那么,哪些物质的组合能够用来设计成实用性电池呢?可以从氧化还原化学的观点来讨论这个问题。
二、电池活性物质的氧化还原化学
要使电池达到实用化的目的,必须具备下列条件:(1)能量密度大;(2)可以大电流放电;(3)对于二次电池,充放电次数要多;(4)自放电少,存放时间长;(5)安全且可靠性高;(6)价格便宜,容易得到。能够符合这些严格条件的电池活性物质的组合是非常有限的。
现从电池电压和活性物质的稳定性加以讨论:
人们将分别参与正极反应、负极反应的物质称为正极活性物质和负极活性物质。先介绍一次电池的电极活性物质,一次电池的特点是电池反应不可逆,即电池中放电反应物消耗后,不可能借外电路反向通电(充电过程)再使其回复到初始状态,因此放电到一定程度后,反应物耗尽,电池就不能再工作了。如今,大部分实用电池把金属氧化物作正极活性物质,锌作负极活性物质,电解液使用碱性溶液,以正极活性物质的金属名作为电池的名称。例如,氧化汞—锌电池![]() 称为汞电池,二氧化锰—锌电池叫做锰干电池(使用氯化锌电解液)及碱性锰电池(使用碱性电解液),氧化银—锌电池
称为汞电池,二氧化锰—锌电池叫做锰干电池(使用氯化锌电解液)及碱性锰电池(使用碱性电解液),氧化银—锌电池![]() 称为氧化银电池。以空气中的氧作为正极活性物质的氧—锌电池称作空气电池。
称为氧化银电池。以空气中的氧作为正极活性物质的氧—锌电池称作空气电池。
一次电池的正极活性物质为什么选择HgO、MnO2和Ag2O这些氧化物呢?以锌—空气电池为例:
负极 Zn(s) + 2OH- (![]() OH-) → ZnO (s) + H2O (l) + 2e-
OH-) → ZnO (s) + H2O (l) + 2e-
正极 1∕2 O2 (g) + H2O (l) + 2e- → 2OH- (![]() OH-)
OH-)
其中![]() ,其逆反应是
,其逆反应是![]() 的氧化,因此,
的氧化,因此,![]() 比0.401V更正的正极活性物质可使
比0.401V更正的正极活性物质可使![]() (即H2O)氧化,自身则有可能被还原成更低级的金属氧化物。而且活性物质与溶剂水反应而终结,属于一种自放电过程,应尽量避免。而处于
(即H2O)氧化,自身则有可能被还原成更低级的金属氧化物。而且活性物质与溶剂水反应而终结,属于一种自放电过程,应尽量避免。而处于![]() 以下(即电势较负)的活性物质是稳定的,此外,选择从负方向的电势范围内尽可能靠近
以下(即电势较负)的活性物质是稳定的,此外,选择从负方向的电势范围内尽可能靠近![]() 的活性物质是有利的,因为,可使
的活性物质是有利的,因为,可使![]() 变得更大。这就是为什么选Ag2O、MnO2作为正极活性物质的原因。它们参与正极反应时的
变得更大。这就是为什么选Ag2O、MnO2作为正极活性物质的原因。它们参与正极反应时的![]() 分别为:
分别为:
Ag2O(s) + H2O (l) + 2e- →2Ag(s) + 2OH-(![]() OH-)
OH-) ![]() = 0.334V
= 0.334V
MnO2 (s) + H2O (l) + e- → MnOOH+ OH- (![]() OH-)
OH-) ![]() = 0.188V
= 0.188V
HgO是一种比Ag2O、MnO2更稳定的活性物质,因其参与正极反应时
![]()
其![]() 较小。
较小。
同理,对于负极活性物质,也可从它与溶剂的氧化还原反应入手评价其稳定性。碱性溶液中,H2O的还原反应
2H2O (l) + 2e- → H2 (g) + 2OH- (![]() OH-) Eθ = −0.828V
OH-) Eθ = −0.828V
因而,电势比它负的负极活性物质会析氢,而本身可能溶解,理所当然不能成为稳定的活性物质。已知
Zn (OH-)42-(![]() ) + 2e- → Zn(s) + 4OH-(
) + 2e- → Zn(s) + 4OH-(![]() OH-) Eθ = −1.245V
OH-) Eθ = −1.245V
比![]() 更负,但已作为很多一次电池的负极活性物质中不可缺少的电池材料。这是为什么呢?主要是由于高纯锌是一种难于析氢的金属,其氢超电势非常大。实际电池中还把比锌的氢超电势更大的汞涂刷在锌表面(汞齐化)。完全阻止了电池在使用期间锌的自放电。从某种意义上说,锌作为负极活性物质是一个例外。现广为使用的一次电池能具有1.5V的开路电压(热力学上分析为1.23V,即水的分解电压),就是由于锌的氢超电势的作用。
更负,但已作为很多一次电池的负极活性物质中不可缺少的电池材料。这是为什么呢?主要是由于高纯锌是一种难于析氢的金属,其氢超电势非常大。实际电池中还把比锌的氢超电势更大的汞涂刷在锌表面(汞齐化)。完全阻止了电池在使用期间锌的自放电。从某种意义上说,锌作为负极活性物质是一个例外。现广为使用的一次电池能具有1.5V的开路电压(热力学上分析为1.23V,即水的分解电压),就是由于锌的氢超电势的作用。
实用电池的活性物质大多是固态,在溶剂中也可使用难溶性化合物或单质。采用碱电解液是为了使氧化物活性物质不溶解。隔膜是构成电池不可缺少的材料,其作用是分隔两极的活性物质以满足产品长期稳定性要求。
现在讨论二次电池的电极活性物质。二次电池是一种可反复使用(放电![]() 充电)的电池,即其电池反应是可以逆转的。电池放电,反应物消耗到一定程度后,还可通过充电,即用外电源对电池反向通电使回复到初始状态,电池又可继续使用。如此充放反复,就起到了一种电能蓄存器(以化学能的形式储存)的作用,故又称为蓄电池。将蓄电池经历一次充电和放电叫一个使用周期。使用周期是衡量二次电池性能的又一重要参数。
充电)的电池,即其电池反应是可以逆转的。电池放电,反应物消耗到一定程度后,还可通过充电,即用外电源对电池反向通电使回复到初始状态,电池又可继续使用。如此充放反复,就起到了一种电能蓄存器(以化学能的形式储存)的作用,故又称为蓄电池。将蓄电池经历一次充电和放电叫一个使用周期。使用周期是衡量二次电池性能的又一重要参数。
铅蓄电池是最普通的二次电池。以硫酸为电解液,![]() 为2.04V,远远高于水的分解电压1.23V,为什么?负极活性物质Pb的标准电极电势
为2.04V,远远高于水的分解电压1.23V,为什么?负极活性物质Pb的标准电极电势
PbSO4 (s) + 2e- →Pb(s) + SO42-(![]() ) Eθ = −0.359V
) Eθ = −0.359V
与锌的情况相同,可能发生析氢,本身溶解,但因Pb的氢超电势也非常大,故可作为理想的负极活性物质。Zn、Hg、Pb是电池负极材料的三大家族。
PbO2的标准电极电势
PbO2(s) + SO42-(![]() )+ 4H+(
)+ 4H+(![]() H+) +2e-
H+) +2e- ![]() PbSO4 (s) + 2H2O (l) Eθ = 1.682V
PbSO4 (s) + 2H2O (l) Eθ = 1.682V
在酸性溶液中它是使H2O氧化的非常强的氧化剂,但在酸性溶液中PbO2是析氧超电势特别大的物质之一,其很正的电势确保了PbO2自身的稳定性。铅蓄电池就是这样把析氧超电势大的PbO2与析氢超电势大的Pb组合起来,利用它们各自的特性,使电池具有高的电压,这在水溶液体系电池中可以说是极佳的组合,铅蓄电池已有100多年的历史,而今仍占据二次电池的主导地位,其原因就在于此。
三、实用化电池
目前已实用化的电池产品中,一次电池有十几种,二次电池有3~4种。
1.一次电池
用锌作为负极活性物质或采用Li的电池,其大部分正极活性物质是使用各种各样的氧化剂。
(1).锰干电池
正极是MnO2,负极为Zn,采用ZnCl2为电解液。电池电压1.5V。电池反应:
正极 8MnO2(s) + 8H2O(l) + 8e- →8MnOOH(s) + 8OH-(![]() OH-)
OH-)
负极 4Zn(s)+ZnCl2(![]() )+ 8OH-(
)+ 8OH-(![]() OH-) → ZnCl24Zn(OH)2(s)+8e-
OH-) → ZnCl24Zn(OH)2(s)+8e-
电池反应 4Zn(s)+ZnCl2(![]() )+8MnO2(s)+8H2O(l) → ZnCl24Zn(OH)2(s)
)+8MnO2(s)+8H2O(l) → ZnCl24Zn(OH)2(s)
电池反应中水作为反应物被消耗,因此它是一种不易泄漏液体的电池。该电池价格便宜、电池性能好,深受消费者喜爱。但放电功率低,![]() 以下不能工作。自放电严重,不宜长期储存。
以下不能工作。自放电严重,不宜长期储存。
(2).碱性锰电池
正、负极的活性物质与锰干电池相同,但使用浓的KOH或NaOH碱性溶液为电解质。电池反应:
正极 2MnO2(s) + 2H2O(l) + 2e- → 2MnOOH(s) + 2OH-(![]() OH-)
OH-)
负极 Zn(s) + 4OH-(![]() OH-) → Zn(OH)42-(
OH-) → Zn(OH)42-(![]() ) + 2e-
) + 2e-
电池反应 2MnO2(s) + Zn(s) + 2H2O(l) + 2OH![]() → 2MnOOH(s) + Zn(OH)42-(
→ 2MnOOH(s) + Zn(OH)42-(![]() )
)
若负极生成的![]() 浓度大于其溶解度,则以Zn(OH)2或ZnO析出。电池电压约1.5V。该电池具有优良的大电流放电特性。低温性能好,其容量也大。
浓度大于其溶解度,则以Zn(OH)2或ZnO析出。电池电压约1.5V。该电池具有优良的大电流放电特性。低温性能好,其容量也大。
(3).二氧化锰—锂电池
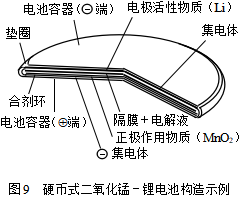
电池的正极活性物质是高温脱水的电解MnO2,电解液是在以丙烯碳酸盐为主体的有机溶剂中加入高氯酸锂(LiClO4)。由于有机溶剂的导电率一般比水溶液体系的低1-2个数量级,因此采取硬币形(图9)的结构,以缩短电极间的距离,从而降低电池电阻。电池反应可表示如下:
Li(s) + Mn(IV)O2(s) → Mn(Ⅲ)O2(Li+)(s)
在正极上发生MnO2还原的同时,负极放电所生成的Li+离子通过固相扩散进入MnO2内。硬币形电池可用于电子计算机、照相机、体温计、数字表和薄型收音机等。
2. 二次电池
二次电池大致分为开放型和密闭型,其电容量范围很宽,从![]() 的超大型到
的超大型到![]() 的钮扣型,而且尺寸、形状也是多种多样。
的钮扣型,而且尺寸、形状也是多种多样。
(1).铅蓄电池
按其构造分开放型和密闭型。电池反应:
正极 PbO2 (s) + 4H+ (![]() ) +SO42-(
) +SO42-(![]() ) +2e- →PbSO4(s) + 2H2O (l)
) +2e- →PbSO4(s) + 2H2O (l)
负极 Pb(s) +SO42-(![]() ) → PbSO4(s) +2e-
) → PbSO4(s) +2e-
电池反应 PbO2(s) + Pb(s) + 4H+(![]() )+2SO42-(
)+2SO42-(![]() ) → 2PbSO4(s) + 2H2O(l)
) → 2PbSO4(s) + 2H2O(l)
该电池放电时消耗硫酸,充电时又生成硫酸。电池端电压为2V。当电池过度放电或闲置时,活性物质就会发生硫酸盐化,有PbSO4析出,使电容量减小,电池不能充电。如果注意保持规定的终止电压,不过充电,则其充放电次数可达300次左右。铅蓄电池可用于维持发电站、变电所的控制功能,保证电讯、电话回路的通畅,也可作计算机用不间断电源、电力贮藏的备用电源,还可作为汽车、特殊照明灯和火灾报警器等的电源。
(2).镍-镉电池
该电池分放置用大型(多数为![]() 以上)电池和密闭小型(
以上)电池和密闭小型(![]() 以下的圆筒型,
以下的圆筒型,![]() 以下的纽扣型)电池两种。电池反应:
以下的纽扣型)电池两种。电池反应:
正极 2NiOOH(s) + 2H2O(l)+2e- → 2Ni(OH)2(s) +2OH-(![]() OH-)
OH-)
负极 Cd(s) + 2OH-(![]() OH-) → Cd(OH)2(s) + 2e-
OH-) → Cd(OH)2(s) + 2e-
总反应 2NiOOH(s) + Cd(s) + 2H2O(l) → 2Ni(OH)2(s) + Cd(OH)2(s)
电池的VK为1.35V,工作电压为1.2V左右,具有优良的大电流放电性能,可在-20℃~60℃的温度范围内工作。其过充电性能好,可靠性高,但价格昂贵。![]() 的大型电池用作车辆、飞机发动机的启动电源,小型密闭式电池用于防灾器械、电气产品、通讯设备和计算机后备存储器等。
的大型电池用作车辆、飞机发动机的启动电源,小型密闭式电池用于防灾器械、电气产品、通讯设备和计算机后备存储器等。
四、未来的电池
目前,新兴化学电源的研究与开发方兴未艾,下面介绍未来将要使用的化学电池。
1. 燃料电池
科学家预言,燃料电池将成为本世纪世界上获得电力的重要途径。它是一种可连续工作、能把燃料氧化的化学能直接转化为电能的电化学装置。其特点是电极的反应物质(提供化学能的燃料和氧化剂)储存在电池的外部,可以根据需要连续加入,产物则随时排出。电极本身在工作时并不消耗和变化。而一般化学电源,反应物质在电池体内,因而容量受电池体积和重量的限制。
燃料电池的能量转换效率不受卡诺循环限制,能量利用率高得多,反应比较安全可靠,不会产生严重的污染。
表2是几种燃料电池产品规格的比较。
表2 燃料电池产品规格比较
产品 |
第一代 |
第二代 |
新一代 |
|
电解质 |
磷酸水溶液 |
熔融碳酸盐 |
固体电解质 |
碱性水溶液 |
电解质内的电荷载体 |
H+ |
CO32- |
O2- |
OH- |
工作温度(°C) |
170~220 |
~630 |
~1000 |
常温~100 |
可使用的反应物 |
H2(含少量CO) |
H2, CO |
H2, CO(碳化氢) |
纯氢 |
可使用的石化燃料 |
天然气(至粗汽油前的轻质油) |
石油 |
石油 |
- |
可使用的合成燃料 |
甲醇(煤气) |
甲醇 |
甲醇 |
- |
使用石化燃料时的发电热效率(%) |
约40(天然气) |
60(天然气,内部改性) |
50~60 |
- |
下面介绍二类燃料电池的特性。
(1).熔融碳酸盐燃料电池
用两种或多种碳酸盐的低熔混合物为电解质,例如Li2CO3(52%)加Na2CO3(48%),把它渗透进多孔性的基质(例如MgO粉末)中,形成导电性隔膜,膜的两侧分别加上负极和正极。电极材料均为烧结镍粉,正极粉末中含多种过渡金属元素为稳定剂。用各种燃料改制成以含CO为主要成分的负极燃气,正极燃气为空气+CO2的混合气。在约630℃电池中的反应如下:
负极 2CO(g) + 2CO32-(![]() ) →4CO2(g) + 4e-
) →4CO2(g) + 4e-
正极 O2(g) +2CO2(g) + 4e- → 2CO32-(![]() )
)
总反应 2CO(g) + O2(g) →2CO2(g)
据说日本已有16.5kW的碳酸盐燃料电池投入运行,电池中能量转换的实际效率约45%~60%。
(2).甲醇燃料电池
该电池有直接式和间接式两种。直接式电池中,甲醇直接加入电解液,使它在固/液界面上发生电化学氧化,酸性电解液中采用铂或碳化钨为电极催化剂,电氧化反应为:
CH3OH(l) + H2O(l) →CO2(g) + 6H+(![]() H+) + 6e-
H+) + 6e-
在碱性液中,醇通过醛、酸等中间产物,最终生成CO2,总反应式为:
CH3OH(l) + 8OH-(![]() OH-) →CO32-(
OH-) →CO32-(![]() ) + 6H2O(l)+ 6e-
) + 6H2O(l)+ 6e-
反应复杂,平衡电势不易达到,中间产物在电极表面的吸附易使电极失去活性。酸性电解液的优点是产物CO2不会与酸作用,可采用磷酸或硫酸为电解液,电池在低温下工作,端电压较低,输出功率也低,大规模合成的甲醇比氢更为价廉。在间接式甲醇燃料电池中,先用高温水蒸气与甲醇作用把它转化为H2和CO2,再用H2做电池的燃料气,约有60%~65%的H2可用于产生电力。美国国立洛斯阿拉莫斯实验室的物理学家正在研制开发一种小型甲醇燃料电池,它与普通充电电池差不多,重量为其一半。其寿命将比标准镍镉电池长50倍,可用20年。估计投放市场后,对美国年产值达10亿美元的移动电话市场是个巨大冲击。而且它还可以用于笔记本电脑和便携式电子设备。更换燃料也极为方便,无需等待数小时充电,倒入42克并不昂贵的甲醇便可以了。
2. 贮存电力的大型二次电池
在我国夜间和白天用电量差异很大,研究以1000kW级为目标的二次电池,把夜间多余的电能储存起来,然后在白天用电高峰将其释放,以使发电量均衡。现介绍三种这类电池:
(1).钠-硫黄(Na/S)电池
电池反应为 2Na(l)+ xS(l) ![]() Na2Sx(l)
Na2Sx(l)
(2).锌-溴(Zn/Br)电池
电池反应为 Br2(![]() ) + Zn(s)
) + Zn(s) ![]() ZnBr2(s)
ZnBr2(s)
(3).氧化还原流动型电池
以金属离子的氧化态(例如Fe3+)作正极活性物质,金属离子的还原态(例如Cr2+)为负极活性物质,并将它们的电解液分别贮存。电池放电时使溶液一边流入带隔膜的电解槽内,一边发电。对于电池
Pt(s)︱Fe3+(![]() Fe3+), Fe2+(
Fe3+), Fe2+(![]() Fe2+)‖Cr3(
Fe2+)‖Cr3(![]() Cr3+), Cr2+(
Cr3+), Cr2+(![]() Cr2+)︱Pt(s)
Cr2+)︱Pt(s)
电池反应为 Fe3+ (![]() Fe3+) + Cr2+ (
Fe3+) + Cr2+ (![]() Cr2+)
Cr2+) ![]() Fe2+ (
Fe2+ (![]() Fe2+) + Cr3+ (
Fe2+) + Cr3+ (![]() Cr3+)
Cr3+)
目前,要研究解决电池的腐蚀与防护对策问题以及生产出为防止两极溶液混合的长寿命、高功能离子交换膜。
3. 高能电动汽车运输电池
作为汽车运输电池要求它有大的功率和能量输出,为了减小汽车载荷电池的重量和体积,要求电池具有高功率密度和高能量密度。此外,还应具备大容量、高可靠性、能耐深度放电、长的充放电循环寿命、耐候性强等性能。这里介绍二类正在开发中的二次电池。
(1).镍-氢电池
镍氢电池是一种新型的二次电池。它是在发现了贮氢合金能够用电化学方法可逆地吸收和放出氢,并能用作可逆贮氢电池电极之后,才得到快速发展的。镍氢电池的负极可采用混合稀土贮氢合金(如LaNiHx,x≤6)或钛-镍合金(MHx),正极采用碱性Ni/Cd电池中的Ni电极技术,并加以改进。电池表达式为:
MHx(s)∣KOH(aq)∣NiOOH(s)∣Ni(s)
电池反应为
MHx (s)+ xNiOOH(s) ![]() xNi(OH)2(s) + M(s)
xNi(OH)2(s) + M(s)
该电池以KOH溶液作为电解液,电池电动势和开路电压值依贮氢合金中金属的种类和贮氢的量决定,电池的理论容量C=![]() 一般工作电压可达1.25V。该电池的主要优点是:能量密度高,无污染,无记忆效应,导电导热性能好,电循环寿命长,耐过充过放电能力强。
一般工作电压可达1.25V。该电池的主要优点是:能量密度高,无污染,无记忆效应,导电导热性能好,电循环寿命长,耐过充过放电能力强。
镍氢电池是近年来发展起来的一种新型高能蓄电池,是目前电动轿车的理想动力源。这一项目也列入我国的“863”计划。北京有色金属研究总院研制出我国第一组轿车用镍氢动力电池,并于2000年首次装车试运行成功,一次充电运行里程达到225km。这标志着我国镍氢电池的研究已达国际先进水平。
(2).锂-硫化铁(Li/FeS,FeS2)电池
Li-S体系具有很高的理论能量密度。实际上它与熔融电解质结合才能实行,此时活性物料也处于液体状态,过程是非常复杂的。因此现在研制的这种蓄电池是使锂和硫都处于结合状态(固体状态)。电池的电池反应为
Li-Al(合金)∣LiCl-KCl(l)∣FeS2(s)
4Li(s) + FeS2(s) ![]() →Fe(s) + 2Li2S(s)
→Fe(s) + 2Li2S(s)
其理论能量密度为![]() 。已研制出这种电池,能量密度为
。已研制出这种电池,能量密度为![]() ,初期电压为1.7V,工作温度在400℃左右,循环寿命约300次。
,初期电压为1.7V,工作温度在400℃左右,循环寿命约300次。
3. 锂电池
正极材料为LiCoO2、LiNiO2、LiMn2O4、LiNi0.5Mn0.5O2等,负极材料为中介相碳微球LiC6,电解质是聚合物电解质或液体电解质,如LiPF6/EC、DMC、DEC等。电解反应如下:
负极 Li1-xC6+xLi++xe- → LiC6
正极 LiCoO2 → Li1-xCoO2+ xLi++xe-
