一、填空题(每题2分,计20分。)
1、热力学第一定律的数学表达式为 ;其适用条件是在 系统中。
2、热力学第二定律的数学表达式为 ;系统的熵 ![]() 与其微观状态数
与其微观状态数![]() 的关系(玻耳兹曼公式)为
的关系(玻耳兹曼公式)为![]() 。
。
3、在温度和物质组成不变的条件下,组分B的化学势 ![]() 随压力
随压力![]() 的变化率
的变化率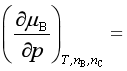 。在压力和物质组成不变的条件下,组分B的化学势
。在压力和物质组成不变的条件下,组分B的化学势![]() 随温度
随温度![]() 的变化率
的变化率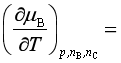 。
。
4、定压下,水和乙醇形成最低恒沸混合物,恒沸组成为95.57%(质量分数),用市售的60°烈性白酒,经过精馏后,气相得到 ,液相得到 。
5、封闭系统中进行的化学反应:![]() 。在反应过程中,
。在反应过程中,![]() 和
和![]() 两者间形成了 ,使反应系统的吉布斯自由能G随反应进度
两者间形成了 ,使反应系统的吉布斯自由能G随反应进度 ![]() 变化的曲线(G—
变化的曲线(G—![]() )上存在一个 点,此点是化学平衡的位置。
)上存在一个 点,此点是化学平衡的位置。
6、对于理想气体反应 ![]() ,反应速率方程有两种表示法:
,反应速率方程有两种表示法: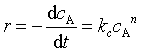 或
或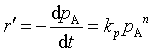 。则
。则![]()
![]() ;
; ![]()
![]() 。
。
7、导体分为电子导体和离子导体,前者的导电能力随着温度升高而 ,后者的导电能力随着温度的升高而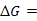 。
。
8、可逆电池的反应热 ![]() 。反应的摩尔焓变
。反应的摩尔焓变 ![]() 。
。
9、在有限电流通过电极时,电极电势偏离平衡电极电势的现象称为 ,定量描述其偏差的大小,引入了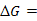 的概念。
的概念。
10、(比)表面吉布斯自由能![]() 。其物理意义是,定温定压下增加单位表面积所引起的系统吉布斯自由能的变化,即单位表面的分子比 的内部分子多出的吉布斯自由能。
。其物理意义是,定温定压下增加单位表面积所引起的系统吉布斯自由能的变化,即单位表面的分子比 的内部分子多出的吉布斯自由能。
二、单项选择题(每题2分,计30分。)
1、某理想气体的热容比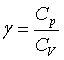 =1.40,则该气体应为
=1.40,则该气体应为
A、单原子分子气体 B、双原子分子气体
C、三原子分子气体 D、四原子分子气体
2、关于热力学第二定律,下列说法不正确的是
A、第二类永动机是不可能造成的
B、热从低温物体传到高温物体,不引起其他变化是不可能的
C、一切实际过程都是热力学不可逆过程
D、功可以全部转为热,但热一定不能全部转化为功
3、在下列过程中,定压下升高温度时,![]() 增加的是
增加的是
A、![]()
B、![]()
C、![]() 溶于水
溶于水
D、![]() 与
与![]() 的混合
的混合
4、5 ℃时,A与B两种气体的亨利系数关系为kA > kB,将A与B同时溶解在某溶剂中达到溶解平衡,若气相中A与B的平衡分压相同,那么溶液中的A、B的浓度为:
A、mA < mB B、mA > mB C、mA = mB D、无法确定
5、下列气体溶于水溶剂中,哪个气体不能用亨利定律
A、N2 B、O2 C、NO2 D、CO
6、NH4HS(s)和任意量的NH3(g)及H2S(g)达平衡时,有
A、C= 2,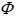 = 2,f= 2 B、C= 1,
= 2,f= 2 B、C= 1,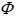 = 2,f= 1
= 2,f= 1
C、C= 2,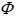 = 3,f= 2 D、C= 3,
= 3,f= 2 D、C= 3,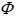 = 2,f= 3
= 2,f= 3
7、化学反应若严格遵循系统的“摩尔吉布斯自由能-反应进度”的曲线进行,则该反应最终处于
A、曲线的最低点 B、起始点与最低点之间
C、终了点与最低点之间 D、曲线上的每一点
8、在一定温度下,反应A+ B →2D的反应速率可表示为 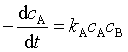 ,也可以表示为
,也可以表示为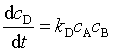 ,则速率系数kA 和kD 的关系为
,则速率系数kA 和kD 的关系为
A、kA =kD B、2kA =kD C、kA =2kD D、没有关系
9、某气相反应在动力学研究中表现为二级,则下面的说法中正确的是
A、它一定是双分子反应 B、它有可能是单分子反应
C、它不可能是复合反应 D、它不是双分子反应,就是复合反应
10、某复合反应的速率系数k与各基元反应速率系数的关系为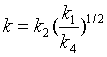 。则该复合反应的表观活化能Ea等于
。则该复合反应的表观活化能Ea等于
A、![]() ; B、
; B、![]() ;
;
C、![]() ; D、
; D、![]()
11、描述电极上通过的电量与已发生电极反应的物质的量之间关系的是
A、欧姆(Ohm)定律 B、离子独立移动定律
C、法拉第(Faraday)定律 D、能斯特(Nernst)定律
12、0.1 mol·kg-1的CaCl2水溶液,其平均活度因子![]() =0.219,则离子平均活度
=0.219,则离子平均活度![]() 为
为
A、3.476×10-4 B、3.476×10-2
C、6.964×10-2 D、1.385×10-2
13、下列电池中,电动势与Cl-离子的活度无关的是
A、Zn︱ZnCl2 (a)︱Cl2(pө)︱Pt
B、Zn︱ZnCl2 (a1)‖KCl (a2)︱AgCl(s)︱Ag
C、Ag︱AgCl︱KCl (a)︱Cl2(pө)︱Pt
D、Pt︱H2(pө)︱HCl (a)︱Cl2(pө)︱Pt
14、金属活性排在氢之前的金属离子,如Na+能优先于H+在汞阴极上析出,这是由于
A、![]() <
<![]() B、
B、![]() <
<![]()
C、![]() <
<![]() D、
D、![]() >
>![]()
15、对于大多数液体,其表面张力随温度的变化率![]() 值
值
A、大于零 B、小于零
C、等于零 D、不能确定
三、判断题(每题2分,计20分。)
1、在等压下,机械搅拌绝热容器中的液体,使其温度上升,则ΔH= Qp= 0。
2、封闭系统中的理想气体,经一不可逆循环过程,则 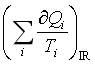 < 0。
< 0。
3、1升乙醇和1升水混合后,其体积刚好等于2升。
4、在一抽真空的容器中放入纯氯化铵固体,反应: ![]() 达到平衡。该反应系统的组分数
达到平衡。该反应系统的组分数![]() 1,自由度数
1,自由度数![]() 1。
1。
5、反应的摩尔吉布斯自由能![]() 是反应产物与反应物之间的吉布斯自由能的差值。
是反应产物与反应物之间的吉布斯自由能的差值。
6、零级反应一定不是基元反应。
7、电解质溶液是电中性的,正、负离子所带总电量相等,所以正、负离子离子的迁移数也相等。
8、自发电池的电池反应一定是氧化还原反应,非氧化还原反应不能设计成电池。
9、用Pt电极电解CuCl2水溶液,阳极上放出Cl2
10、只有在比表面很大时才能明显地看到表面现象,所以系统表面增大是表面张力产生的原因。
四、简答题(每题5分,计20分。)
1、有人说:“任意可逆过程中ΔS=0,任意不可逆过程中ΔS>0。”正确吗?
2、沸点和恒沸点有何不同?
3、反应:![]() 能否是基元反应?为什么?
能否是基元反应?为什么?
4、一支玻璃毛细管分别插入25 ℃和75 ℃的水中,则毛细管中的水面哪个高一些,为什么?
五、计算题(每题5分,计10分。)
1、求下列过程的熵变:(1)1mol O2在298K等温膨胀至压力为原来的1/10倍;(2)1mol He在恒压条件下由300K加热到600K;(3)5mol N2在恒容条件下由448K冷却到298K。设气体均可视为理想气体。
2、在291.15K时,已知Ba(OH)2、BaCl2和NH4Cl溶液在无限稀释时的摩尔电导率分别为0.04576 S·m2·mol-1、0.02406 S·m2·mol-1和0.01298S·m2·mol-1,试求算该温度时NH4OH溶液的极限摩尔电导率。
资料下载:
模拟卷一
