一、填空题(每题2分,计20分。)
1、系统达到热力学平衡态时,需要满足: 平衡、 平衡、相平衡和化学平衡这四个平衡条件。
2、熵的热力学定义式是![]() ;在封闭系统中,公式
;在封闭系统中,公式![]() 成立的条件是 。
成立的条件是 。
3、偏微商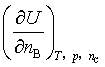 的名称叫 ;偏微商
的名称叫 ;偏微商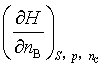 的名称叫 。
的名称叫 。
4、相平衡系统的组分数![]() ,其中
,其中![]() 是 数,
是 数,![]() 是独立的 数。
是独立的 数。
5、反应的摩尔吉布斯自由能![]() 的定义式是:
的定义式是:![]() ,它与标准摩尔吉布斯自由能(变)
,它与标准摩尔吉布斯自由能(变)![]() 的关系是:
的关系是:![]()
![]()
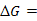 。
。
6、根据拟定的反应机理,推导总反应的速率方程时,可采取一定的近似方法,其中包括速率控制步骤(速控步)、 近似 和 假设三种方法。
7、在室温下,Li+、Na+、K+极限摩尔电导率的大小关系是:![]()
![]() ,
,![]()
![]() 。
。
8、电极![]() |
|![]() 属于第 类电极,电极
属于第 类电极,电极![]() |
|![]() |
|![]() 属于第 类电极。
属于第 类电极。
9、采用“三电极法”测量待测电极(研究电极)的超电势时,另外需要两个电极,即 电极和 电极。
10、弯曲表面的附加压力(拉普拉斯公式)表示为:![]() ;悬浮在空气中的肥皂泡,其泡内的压力为:
;悬浮在空气中的肥皂泡,其泡内的压力为:![]() 。
。
二、单项选择题(每题2分,计30分。)
1、某封闭系统经历等压过程,功的表示式为
A、![]() B、
B、![]()
C、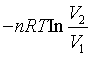 D、
D、![]()
2、对于熵增加原理,下列表述错误的是
A、隔离系统的熵永不减少
B、在绝热过程中,系统的熵永不减少
C、在不可逆过程中,系统的熵总是增加的
D、隔离系统和绝热系统中不会发生熵减少的过程
3、25 ℃时,0.01 mol·kg-1糖水的凝固点为T1,渗透压为Π1;0.05 mol·kg-1糖水的凝固点为T2,渗透压为Π2。则下列关系中正确的是
A、![]() B、
B、![]()
C、![]() D、
D、![]()
4、对于同一化学反应,反应式写法不同,例如(1)N2 + 3H2 = 2 NH3;
(2)![]() 。则下列叙述正确的是
。则下列叙述正确的是
A、∆rGm不变 B、Kp不变
C、![]() 不变 D、
不变 D、![]() ,正向自发
,正向自发
5、关于水的相图,下列说法正确的是
A、在三相点处,![]() ;在临界点处,
;在临界点处,![]() 。
。
B、当冰与水处于两相平衡时,压力随温度的变化率![]() < 0
< 0
C、在相图中的曲线上,![]() ,
,![]()
D、三相点的温度低于冰点的温度
6、均相反应 A + 2D → 3G 在298 K及1 dm3的容器中进行,若某时刻反应进度随时间变化率为 0.30 ![]() ,则此时G的生成速率为(单位:
,则此时G的生成速率为(单位:![]() )
)
A、0.10 B、0.90 C、0.15 D、0.20
7、温度T时,某理想气体反应的速率方程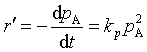 ,pA是为反应物的分压力,若将速率方程表示为
,pA是为反应物的分压力,若将速率方程表示为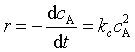 ,则下列关系正确的是
,则下列关系正确的是
A、![]() ,
,![]()
B、![]() ,
,![]()
C、![]() ,
,![]()
D、![]() ,
,![]()
8、按导体导电方式的不同而提出的第二类导体,下列哪一点对于它特点的描述是不正确的?
A、其电阻随温度的升高而增大
B、其电导随温度的升高而增大
C、其导电的原因是离子的存在
D、当电流通过时在电极上有化学反应发生
9、298.15 K时,某电池反应为Zn(s)+Mg2+(a=0.1)![]() Zn2+(a=1)+Mg(s),实验测得该电动势E=-0.2312V,则电池的
Zn2+(a=1)+Mg(s),实验测得该电动势E=-0.2312V,则电池的![]() 为
为
A、0.2903V B、-0.2312V
C、0.0231V D、-0.202V
10、用铜电极电解0.1 mol·kg-1CuCl2水溶液,阳极上的反应为
A、2C1-![]() C12+2e- B、Cu
C12+2e- B、Cu![]() Cu2+ + 2e-
Cu2+ + 2e-
C、Cu![]() Cu++e- D、2OH-
Cu++e- D、2OH-![]() H2O +
H2O +![]() O2 + 2e-
O2 + 2e-
11、在相同的温度及压力下,把一定体积的水分散成许多小水滴,经这一变化过程以下性质保持不变的是
A、总表面能 B、比表面
C、液面下的附加压力 D、表面张力
12、在下列变化中,![]() 为负值的是
为负值的是
A、冰融化成水
B、液态水沸腾变成水蒸气
C、电解水生成氢气和氧气
D、![]()
13、在298.2 K、101325 Pa压力下,两瓶体积均为1 dm3萘溶于苯的稀溶液,第1瓶中含萘1 mol;第2瓶中含萘0.5 mol。若以![]() 及
及![]() 分别表示两瓶萘的化学势,则
分别表示两瓶萘的化学势,则
A、![]() >
>![]() B、
B、![]() <
<![]() C、
C、![]() =
=![]() D、不能确定
D、不能确定
14、用同一电导池分别测定浓度为0.01 mol·dm-3和0.1 mol·dm-3的不同电解质溶液的电阻,其值分别为1000 Ω及500 Ω,则它们的摩尔电导率之比是
A、1:5 B、5:1 C、1:20 D、20:1
15、若水在半径为r的玻璃毛细管中上升高度为h,则在1/2h处将毛细管折断,此时管中的水面的曲率半径将
A、变大 B、变小
C、不变 D、无法判断
三、判断题(每题2分,计20分。)
1、在某一封闭系统中,当始态和终态确定后,如果经历一个绝热过程,则功有定值。
2、在373 K、101.325 kPa时,H2O(l)变为H2O(g),此变化的ΔA < 0。
3、理想稀溶液中溶剂分子与溶质分子之间只有非常小的作用力,以至可以忽略不计。
4、液态水的密度大于冰的密度,则冰与水处于两相平衡时,压力随温度的变化率 ![]() <0。
<0。
5、任何一个化学反应都可以用![]() 来判断其反应进行的方向。
来判断其反应进行的方向。
6、基元反应:![]() 的活化能
的活化能![]() 等于键能
等于键能![]() 。
。
7、无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
8、严格说来,由两个不同电解质溶液构成的具有液体接界的电池,都是热力学不可逆的。
9、分解电压就是能够使电极反应发生所需要的外加电压。
10、在相同温度压力下,分子间作用力越大的液体,其表面张力越大。
四、简答题(每题5分,计20分。)
1、“可逆过程中系统的熵不变,不可逆过程的熵增大。”这种说法对吗?
2、青藏高原的气压为65.8 kPa,为什么在青藏高原用一般锅不能将生米烧成熟饭,而要用高压锅才能煮熟?
3、 “一个化学反应进行完全所需的时间是半衰期的两倍。”此判断正确吗?
4、联系电化学与热力学的主要桥梁是什么?并据此说明为什么要引入可逆电池的概念?
五、计算题(每题5分,计10分。)
1、某乙醇的水溶液,含乙醇的摩尔分数为x(乙醇) =0.0300。在97.11℃时该溶液的蒸气总压力等于101.3 kPa,已知在该温度时纯水的蒸气压为91.30 kPa。若该溶液可视为理想稀溶液,试计算该温度下,在摩尔分数为x(乙醇)=0.200的乙醇水溶液上面乙醇和水的蒸气分压。
2、当有碘存在时,氯苯![]() 与氯在
与氯在![]() 溶液中有以下平行反应(碘为催化剂)
溶液中有以下平行反应(碘为催化剂)
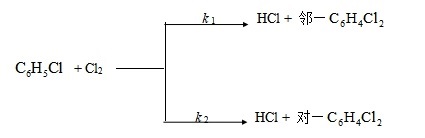
设在定温下和碘的浓度一定时,![]() 和Cl2在
和Cl2在![]() 溶液中的初始浓度均为
溶液中的初始浓度均为![]() ,已知30分钟后有15 ﹪ 的
,已知30分钟后有15 ﹪ 的![]() 转化为 邻-
转化为 邻-![]() ,有25 ﹪ 的
,有25 ﹪ 的![]() 转化为 对-
转化为 对-![]() ,试求反应的速率常数k1和k2。
,试求反应的速率常数k1和k2。
资料下载:
模拟卷二
