第五章课后习题参考答案
5.简述[Re2Cl8]2-
的成键过程,说明它的构象,为什么它是重叠型的?
解: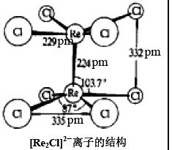
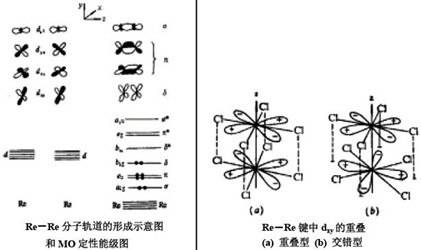
[Re2Cl8]2- 共有24个价电子。8个Re -Cl键用去16个,剩下8个用来构成Re-Re键他们填充在一条σ
两条π和一条δ分子轨道中, 共得到4条成键分子轨道,相当于一个四重键。如此高的键级可说明金属金属键的缩短。Re-Re四重键能约为300~ 500
kJ?mol 1 ,比一般单键或双键键能都高,故含四重[Re2Cl8]2-
能够稳定存在。
假如把[Re2Cl8]2- 中的某一个Re-Cl 平面旋转45℃ 使成交错型(右下图),
这时,虽然降低了Re-Cl 键的排斥能,但两个Re 原子的dxy 轨道不再重叠,δ 键因此而遭破坏,键级降低,键能减小,这就是为什么?[Re2Cl8]2-
不采取交错型而采取重叠型的理由。完全是由于δ 键对空间构型所起的重要作用。不过,由于dz2 轨道重叠最大,dxz 和dyz 其次,dxy 最小。所以Re-Re
四重键中δ 成分对总键能的贡献较小。
6.回答下列问题:
(1) 为什么羰基化合物中过渡元素可以是零价(如Fe(CO)5)或者是负价(如[Co(CO)4]-)?
(2) 为什么金属Mn、 Tc、 Re、Co 、Rh 、Ir 易形成多核羰基化合物?
(3) 为什么CO 、RNC 和PF3 能形成类似的有机金属配合物?
解:(1)羰基配体为π -酸配体,可接受来自中心金属的d(p)电子形成反馈π
-键,σ -π 协同成键的结果使化合物能稳定存在。首先,当金属为0价或负价时,有多余的d 电子可以反馈出,其次,当金属为0 价或负价时,价轨道较为扩展,有利于轨道重叠。相反,当金属为高价时,或没有多余d
电子馈出,或价轨道收缩,不利于重叠。
(2)① 多核羰基化合物中必定存在金属键,如果金属价轨道中d 电子太多,电子间的相互排斥妨碍金属键的生成,如果金属价轨道中d 电子太少,金属无多余d
电子反馈给属于π-酸配体的CO 生成反馈π 键,这些元素其d 电子分别为5、 7 个,不太多,也不太少,正好适合金属键和反馈π 键的生成。②
这些元素都是奇电子,其单核羰基化合物亦为单电子,故易相互聚合形成金属键。
(3)他们均属于π-酸配体和以相同的σ+ π 的协同成键方式成键,因此能形成类似的有机金属配合物.
7.CO 是一种很不活泼的化合物,为什么它能同过渡金属原子形成很强的配位键?CO 配位时配位原子是C 还是O ?为什么?
解:因CO 是一个π-酸配体,σ +π
的协同成键方式使得配位键强。CO 是以C 作为配位原子的,这是因为O 的电负性很大,其孤对电子的能量低之故。
8.解释下列事实:
(1) V(CO)6 容易还原为[V(CO)6]- 但V2(CO)12
还不如V(CO)6 稳定;
(2) 通常Ni 不易氧化为Ni3+ ,但Ni(C5H5)2
中的Ni2+ 却易氧化假定其分子轨道类似于二茂铁。
(3) WCp2H2 和ReCp2H 具有倾斜夹心型结构.
解:(1) V(CO)6
有5 +12= 17e ,故易得到电子形成满足EAN 规则的V(CO)-6 V2(CO)12
虽然满足EAN 规则,但V 的配位数为7, 与配位数为6 的V(CO)6 相比,空间过分拥挤,空间位阻作用使其稳定性减小。
(2) Ni(C5H5)2 有20 个电子,在反键分子轨道中有两个单电子,如果因被氧化而失去一个电子,可以减小反键中的电子,增加键级,从而增加分子的稳定性。
(3) W的两个H- 配位离子及Re 的1个H-配位离子使其两个Cp不再平行。