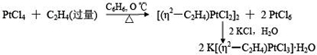第五章课后习题参考答案
9.如何制备二茂铁和蔡斯盐?比较二者成键方式的异同点。
解:
反应中形成的PtCl6 可被过量已烯还原为铂.生成物K[(η2-C2H4)PtCl3]·H2O
为黄色固体,这就是我们熟知的Zeise 盐。
Zeise 盐的[Pt(η2 -C2H4)Cl3]-
阴离子部分具有平面正方形的几何构型,3 个Cl 和Pt 在同一平面内,乙烯分子位于正方形的第四个顶点。两个C 原子与Pt(Ⅱ)等距离,由于已烯的反位影响,使反位Pt
-Cl 键稍长,平面正方形略有变形.C=C 键和正方形平面呈84°角,乙烯配体中的4个H 原子对称地远离Pt(Ⅱ)离子而向后弯折,致使乙烯分子不再是一个平面型分子。
Chatt 和Duncanson(1953 年)提出了用于定性解释Pt(Ⅱ)-C2H4之间的化学键的DCD模型。
DCD 模型认为:当乙烯和Pt(Ⅱ)成键时,乙烯充满电子的π 轨道和Pt(Ⅱ)离子的dsp2杂化轨道重叠,形成三中心σ配键
其中Pt(Ⅱ)是电子对的受体,乙烯分子是电子对给体。同时Pt(Ⅱ)离子充满电子的d 轨道和乙烯的反键π*轨道重叠形成另一个三中心π
反馈配键,
此时,Pt(Ⅱ)是电子的给体,乙烯分子是电子的受体。因此Pt(Ⅱ)-C2H4
之间的化学键为σ- π 配键(右图)。
二茂铁的制备方法校多,如
(1) 碱金属盐法:
用环戊二烯钠和无水金属卤化物或羰基化合物在THF 中反应:
(2) 胺盐法:
工业上用铁粉和乙胺盐熔融,产生无水FeCl2 ,然后在碱性试剂有机碱(Et2NH)存在下与环戊二烯作用制备金属茂。

其中有机胺Et2NH能移去环戊二烯上的氢和除去反应中生成的HCl,使反应在较低温度下进行.本法原料为铁粉,价格便宜,且胺盐能循环使用。
(3) 格林试剂法:
用格林试剂C5H5MgBr 与FeCl3 作用制备二茂铁其中Fe3+
被格氏试剂还原为Fe2+, 再与C5H5MgBr 反应生成了(η5-C5H5)2Fe:
(4) 高温直接反应法:
用环戊二烯和铁在高温下反应,也可制得了二茂铁。
(5) 羰合物反应法:
Fe的羰合物与环戊二烯发生配体置换反应,也可以生成二茂铁:
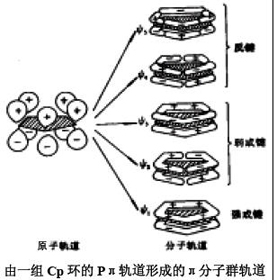
金属茂(η5-C5H5)2Fe的定性分子轨道能级图示于下图一,其中每个Cp环都可以看作是正五角形,具有5条π
分子轨道。他们构成一组强成键,一组二重简并的弱成键和另一组二重简并的强反键分子轨道(下图二), 两个Cp环共组成10
条配体群π 轨道分别具有a﹑e1﹑和e2对称性。
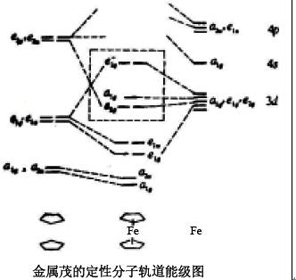
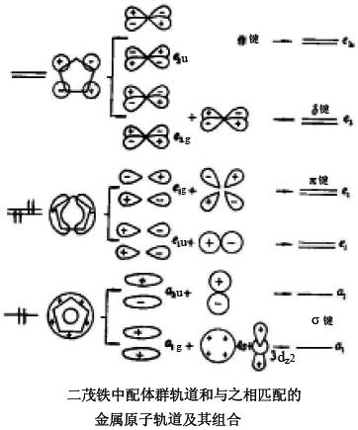
在能级图中,左边是配体两个Cp环的10 条π 轨道,右边是第一系列过渡元素的9条价轨道(3d、4s、4p),中间是两个Cp 环的π 轨道和金属价轨道组成的19条分子轨道,其中有9条成键和非键分子轨道,以及10条反键分子轨道(能量较高的反键轨道在图中未全部画出)
,图中虚线框里表示的是前线轨道。
由Cp的配体群轨道与Fe 原子的价电子轨道按对称性相当原则匹配成的二茂铁的分子轨道示于左下图。由图可见配体e2u
轨道在铁原子中找不到对称性与之相当的原子轨道,因而仍保留原来轨道的能级成为非键轨道。
根据(η5-C5 H5 )2 M 的分子轨道能级图,配体的a2u
﹑a1g ﹑e2g 虽然与铁原子的相应轨道对称性相当,但由于能级差太大,也不能成键,分别成为非键轨道。只有配体的e1g
与铁原子的e1g 轨道不仅对称性相当,而且能级也最接近,故能形成两个强的π 键。因此Fe2+ 的6个价电子和两个Cp环的12个电子共18个电子(正好符合EAN规则),分别填入a1g
、a2u 、e1g 、e1u 、e2g 和a1g
9条成键和非键分子轨道中,10条反键轨道全空,所以二茂铁分子是十分稳定的。分子中不存在单电子,因而二茂铁具有抗磁性。另外,由于填充的轨道或者是a,或者是成对的e1和e2,所以他们是主轴对称的,可以推测不存在高的转动势垒,所有这些都与实验事实相符。