|
溶剂凝固点测定的结果表示为:(5.797±0.005)
溶液凝固点T测量三次,其读数分别为5.500、5.504、5.495,按上述方法计算可求得溶液凝固点测定的结果表示为:5.500±0.003。溶液凝固点降低数值可表示为:
T*f-Tf=(5.797±0.005)-(5.500±0.003)=(0.297±0.008)。
从中可知:凝固点降低的平均值为△Tf =0.297,
凝固点降低测量的平均误差△(△Tf) =±0.008。
当以平均误差表示最终结果时,写为M±△M;其中M为分子量的测定值,△M为分子量测定经传递的平均误差。因为
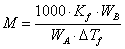
依平均误差传递公式:
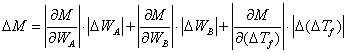
式中
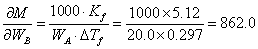
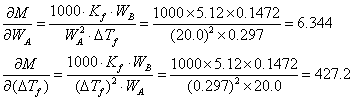
代入平均误差的传递公式得
△M=862.0×0.0002+6.344×0.05+427.2×0.008 = 3.907≈4
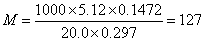
最终结果表示为:M=127±4(g/mol)
6.实验误差的估计
根据被选定的实验内容和实验体系,分析所用仪器及实验步骤中可能产生最大误差的因素,从而引起操作上的注意,这种分析称为对实验误差的估计。这种估计可以为选择仪器装置及试剂等级提供依据。
以下以“凝固点降低法测分子量”实验加以说明如何估计实验的误差。
在此实验中,用台秤称量溶剂,分析天平称量溶质,并用贝克曼温度计测量凝固点的降低值,从表-3中得到函数关系为乘、除时被传递的相对平均误差的公式,可推知,分子量测定的相对平均误差为:
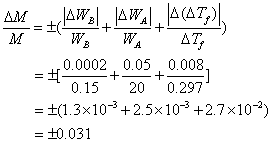
式中0.0002克为分析天平称量溶质时的绝对误差,0.15为溶质克数;0.05克为台秤称量溶剂时的绝对误差,20为溶剂克数;0.008是用贝克曼温度计测量凝固点降低值时(溶剂、溶液各测量三次)带来的绝对误差,0.297为凝固点降低的值;上式看出,当在实验时,使用上述仪器,实验最大的相对误差为3.1%。
若用刻度为1/10的温度计代替刻度为1/100贝克曼温度计,当其他条件不变时,按每次测温的绝对误差都增大10倍计,则
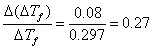
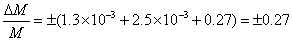
即此时测定分子量的相对误差从3.1%升到27%,很明显,所得分子量测定结果误差太大,改用刻度1/10的温度计测量显然是不适宜的。
同样,提高溶剂称量的精度,而其他条件不变时改用分析天平来称量溶剂时,称量的精度从0.05g提高到0.0002g,则:
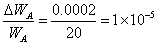

计算表明,这时对分子量的测定的相对误差从3.1%降到2.8%,对最后结果影响并不太大,很显然,不必要用分析天平称量溶剂。
同样,对于溶质的称量,由于溶质少,所以用分析天称量是必要的。但是,溶质计量的精度如果稍有降低,对测定结果影响也并不太大,例如当称量精度降低一倍,即其误差为△WB=0.0004时,则:
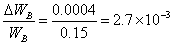

可见称量溶质精度降低一倍,最大相对误差只从3.1%增大到3.2%,只增加了0.1%,因此在此实验中,往往可以加入少量固体溶质作为凝固过程的晶种,以避免过冷现象出现而影响温度读数的精确性,这种做法的结果往往反而提高实验的精确度。
以上分析说明,在此实验中测温的精确度(包括温度计的精度和操作技术条件)是造成这种误差的主要原因,如果要提高用凝固点降低法测分子量的精确度,首先要考虑提高测温的精确度。反之,测温精确度的降低必将大大增加分子量测定的误差。
事先估计各项所测的误差及其影响,将指导选用精密度适宜的仪器和选择正确的实验方法,控制适宜的条件并抓住测量的关键,从而得到精密度较高的实验结果。
┆1 2 3 4┆
|